Эфиры эстрамастина или их фармацевтически приемлемые соли и способ их получения
Номер патента: 4438
Опубликовано: 14.03.1997
Авторы: Пер-Олов Гуннар Гуннарссон, Свен-Аке Йоханссен, Бертиль Вальдемар Хансен, Хенри Рене Молльберг
Формула / Реферат
ЭФИРЫ ЭСТРАМАСТИНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ
(57) Использование: в качестве пероральных противоопухолевых средств. Сущность изобретения: продукт: эфиры эстрамастина формулы (см.рис), где
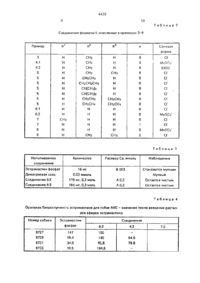
R1 - Н, алкил С1- С4. R2 - Н, алкил С2 -С4 , R3 - Н,
алкил С1 -С4, п = 0, 1, 2, или их фармацевтически приемлемых солей Выход: 80 - 90%. Реагент 1: эcтрамастин. Реагент 2: аминокислота
HOOC-CHR1-(CH2) -NR2R5. где R1, R2 имеют указанные значения. R 5=R3 или защитная группа. Условия реакции: в среде метиленхлорида и в присутствии дициклогексилкарбодиимида, для снятия защитной группы гидрируют водородом над палладием на угле. 2 с и 3 зп ф-лы, 4 табл.
Текст
Изобретение относится к новым эфирам астрамастина и способу их получения,а именно эфиров обшей формулы ЕРЕЗ атом водорода, низший алкил СтСл или 82 и На вместе -СН 2-СН 2-СН 2-СН 2-.или их фармацевтически приемлемых солей. обладающих противоопухолевыми свойствами.Цель изобретения получение новых производных экстрамастина. образующих водорастворимые кальциевыесоли и пригодных для орального применения при лечении рака предстательной железы.Синтез ведут этерификацией зстрамастина аминокислотой обшей формулыс получением продукта общей формулыгде 84 группа 448285 с последующим удалением защитной группы с получением целевых продуктов . Эстрамастин, эстра-1,3.510 триен З,17 в-диоп-З-М.М-бис(2- клорзтилъсарбамат и его различные эфиры хорошо известны вкачестве противоракеты) агентов. Один из них, 1 Я-эстрамастиндигидрогросфат (ЭМФ),был изучен более широко, и его водный раствор (остроцит) теперь Широко ориг/леняетсл при лечении рака предстательной железы. Проблема орального применения ЭМФ состоит во взаимодействии с ионами кальция. содержащимися в пицце и питье. В присутствии ионов кальция отлов дает оса док и образует нерастворимый комплекс,который не адсорбируется пищеварительным трактом и таким образом имеет очень маленькую акттпвность в организме. Было сделано несколько попыток решить ату проблему, как относительно Фармацевтического получения ЭМ-Ф солей. так и самого экстрамастина. Однако оказалось навоз можныгл найти такую модификацию ЭМФ для орального применения. которая бы обеспечила в плазме такой же уровень важнейшего метаболита ЭМФ экстрамастина, и соответствующего П-кетопроизводногозкстрамастъттаа. какой дает водорастворимап натриевая соль ЭМФ в отсутствии ьчонов кальция.Эфиры аминокислот для фармацевтических цепеп описаны. Однако зги эфиры спиртов, хотя и содержащие стероидный скелет, имеют структуру, весьма отличающуюся от структуры эстрамастина.Эстрамастин 4.4 г 0.01 моль растворяют втопуоле (100 мл). Хлорацетьтлхлорид 1.7 г. 0.015 моль прибавляют в раствор и нагревают при 70 С 1.5 ч. Растворитель затем удаляют в вакуумном таспаритепе при 30 С. Остаток обрабатывают этанолом и продукт кристаллизуется. Продукт фильтруют н промывают несколькими пииллилитрами этанола. Хлорацетат после сушки при комнатной температуре плавится при 95 С. Выход 4.9 г.Данное соединение получено методом сходным сопьтсанным в примере 1 из эстрамастина и бромацетьтлбромида, тпл. 109 С.Пеэстрамастин хлорацетат 5.2 г 0.01 моль) растворяют в ацетонитригте (40 мл при комнатной температуре. Метипамин ЗА г 0.1 моль растворяют в холодном ацетонитриле и прибавляют при ОПС. После 3 ч избыток амина и растворитель удаляют в роторном испарителе. Остаток растворяют в клористогл метилене (50 мл и трижды промывают 50 мл воды. устанавливая каждый раз рН раствором бикарбоната натрия7-9. органическую фазу сушат безводным сульфетом натрия и удаляют растворитель. Остаток растворяют в ецетонитриле 40 мл) и осаждают М-метилвминоацетат путем добавления раствора хлороводорода в эфире (0012 моль). Образуется объемный осадок. который после перемешивания втечение нескольких минут распадается на прекрасные кристаллы. Продукт отфильтровывают и промывают смесью этилацетата и ацетонитрила 11. Затем гидрохлорид сушат под вакуумом при комнатной температуре 24 ч. Выход 3.7 г. Т.пл. 22 бС с разл. ЯМР-спектроскопия показывает. что продукт имеет структуру зстрамастин 17-М-метилацетат.Используя метод, описанный в примере 3. за исключением применения растворов метансульфоноеой и зтансульфоновои кислоты е эфире вместо хлороводорода в эфире были получены метансульфонат и зтансульфонат, т.пл. 212 С и 17 ОС соответственно.Эфиры имеющие заместители 122 и На описаны в табл. Получены из 17-эстрамастина бромацетата с использованием метода примера 3 с небольшими изменениями.(Од г. 0.001 моль и перемешиваютреакционную смесь 3 ч. образующую дициклогексилмочевину удаляют фильтрованием и упаривают растворитель. Маслообразныи осадок растворяют в ецетонитриле (10 мл) и прибавляют ацетонитрил (40 мл). содержащий хлористый водород (3503 моль) и перемешивают смесь 16 ч. Образующийся осадок отфильтровывают и перекристаллизовывают из смеси эфир-метанол. Выход 3.2 г 17-эстрамастин аминоацетата гидрохлорида (т.пл. 220 С. соединение 6.1). как подтверждено ЯМР-спектроскопией. Таким же методом. за исключением использования метансульфоноеой кислоты вместо клороводорода и отсутствием кристаллизации получен 17-зстрамастин аминоацетат метансульфат соединение 6.2). т.пл. 2 О 6 С.Следующие соли были получены. используя метод. описанный в примере 6(22 г. 0.01 моль) дициклогексилкарбодиимид 0.12 г 0.001 моль. Смесь перемешивают при комнатной температуре 2 ч. Образующуюся дициклогексил мочевину отфильтровывают. фильтрат промывают соляной кислотой (2 М 10 мл). водой (10 мл),раствором карбонатанатрия (1 М 25 мл) и опять водой (25 мл) и сушат сульфетом нетрия. Растворитель упаривают в роторном испарителе Оставшееся масло растворяют в этаноле (125 мл). Прибавляют палладий на угле 1 г. содержание палладия 5) и обрабатывают смесь водородом при комнатной температуре и атмосферном давлении. Когда реакция прекращается, смесь фильтруют и растворитель упарива ют. Остаток растворяют в ацетонитриле (75 мл). Добавляют метансульфоновую кислоту (1 г. 0.01 моль). После 18 ч перемешивания остаток отфильтровывают. промывают ацетонитрилом и сушат при комнатной температуре. Выход 17-зстрамастин аминоацетат метансульфоната 3.7. т.пл. 2 О 4 С.К зстрамастину (д.41 г 0.01 моль) в хлористом метилене (50 мгоприбавляют д-диметиламинобутирилхлорид гидрохлорид (13 г. 0.01 моль). Раствор кипятят 2 ч. Упариеают растворитель и полученное масло кристаллизуют. Продукт обрабатывают активироЕВННЫМ УГЛВМ Е ЭТЭНОПЬНОМ ПЗСТВОПВ И псрекристалличовывают из смеси этанолзфир. Выход 6.5 г. Т.пл. 205 С. Как подтверждено ЯМР-спектроскопиеи продукт является П-зстрамвстин д-(ММ-диметиламинщбутирэтом гидрохлоридом, П р и м е р 10. Взаимодействие с ионами кальция.Раствор А 0.3 М диэтансульфонат кальция. Карбонат кальция ЪЗВ г 15 ммоль) растворяют при добавлении 1 н. раствора зтансульфокислоты до получения постоянного рН 5.3. Раствор разбавляют водой до 50 мл.Раствор В 0.03 М диэтансульфонат кальция. Одну часть раствора А разбавляют 9 ч. воды.Раствор С 0.05 М ацетатный буфер с рН 4,5. ледяную уксусную кислоту (30 г 0.05 моль) растворяют е 800 мл воды, титруют 1 М раствором гидроксида натрия до рН 4.5 и разбавляют до 1 л. испытываемое соединение растворяют 50 мл раствора-С. Чистый раствор образуется через несколько минут. Спустя 5 мин вводят зквимолярное количество ионов кальция прибавлением раствора А или В. За смесью наблюдают 3 ч (см.табл.З.Результаты показывают. что новые соединения в присутствии ионов кальция не дают какого бы то ни было осадка в концентрации в 10 раз большей. чем концентрация эстрамастин фосфата динатриевой соли. необходимой для немедленного образования нерастворимой кальциевой соли экстремастин фосфата.П р и м е р 11. Сравнение эстрамастинфосфата и эфиров эстрамастина в аспекте оральной биодоступности эстрамастина на собаках.Различные рецептуры орапьно вводились грулпе из четырех гончих собак. доза была эквивалентна НО мг эстрамастин фосфата. Животнык не кормили до принятия дозы и давали им 50 мл 0,01 М соляной кислоты после принятия. Образцы крови анализировали на зстрвмастии при помощи газовой хроматографии.Были использованы следующие рецепТУВН 1, Водный раствор динатриевой соли фосфата эстрамастина. 2.Водный раствор соединения 6.2. 3.Водный раствор соединения М 4.2. 4. Водный раствор соединения 7.2.Табл.4 показывает области под кривыми изменения концентрации экстрамастина в плазме крови собак во время. Средние значения составляли 54162, 118 50. ВЗ 62 и 174 В 3 нг/мл -ч для эстрамастинИспользовали несколько доз. Полученные значения экстраполировали до дозы эквивалентной дозе других соединений.смешивают и гранулируют с раствором Н. После сушки и просеивании через сито 1 мм прибавляютН . Смесь прессуют в таблетки массой 200 мг.СН 3 СН 3 СНа СН 2 СН 3 СН 2 СН 2 СН 3 СЩСНЗЪ СНШНЗЬ СН 2 СН 3 СН 2 СН 4 Н НЭстрамастин фосфат 1 Б мг В 003 Становится мутным Динатриевалсоль 0.03 ммоль Мутный Соединение 62 178 мг. 0.3 моль А 0.3 Остается чистым Соединение 42 186 мг. 0.3 моль А 0.3 Остается чистымОральная Биодоступность зстрамастина для собак АПС знечения после введения растворов эфиров эстрамастинаНомер собаки Эстраместин Соединение ФШФЭТ 1 73
МПК / Метки
МПК: C07J 1/00
Метки: эстрамастина, эфиры, получения, способ, приемлемые, фармацевтически, соли
Код ссылки
<a href="https://kz.patents.su/6-4438-efiry-estramastina-ili-ih-farmacevticheski-priemlemye-soli-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Казахстана">Эфиры эстрамастина или их фармацевтически приемлемые соли и способ их получения</a>
Предыдущий патент: Способ получения нуклеозида или его фармацевтически приемлемых солей
Следующий патент: Производные 17бета-замещенных-4-аза-5альфа-андростан-3-онов, способы получения соединений, фармацевтический состав, соединение IV
Случайный патент: Приставка к бытовому пылесосу