Транзиентная экспрессия генов рекомбинантных белков GFP и Г-КСФ человека в растениях N.benthamiana
Номер инновационного патента: 31056
Опубликовано: 15.04.2016
Авторы: Абеуова Лаура Сериккызы, Манабаева Шуга Аскаровна, Раманкулов Ерлан Мирхайдарович
Формула / Реферат
Изобретение относится к области генетической инженерии и биотехнологии растений, в частности к способам экспрессии генов рекомбинантных белков в клетках растений и может быть использовано для продукции и выделения рекомбинантного зеленого флуоресцентного белка и гранулоцитарного колониестимулирующего фактора человека.
Технической задачей изобретения являлось разработка способа транзиентной экспрессии генов, кодирующих рекомбинантные белки в растениях с помощью вирусного вектора, созданного на основе генома ВККТ.
При решении технической задачи синтезированы гены, кодирующие зеленый флуоресцентный белок и гранулоцитарный колониестимулирующий фактор человека кодон оптимизированные для экспрессии в клетках растений N.benthamiana длиной 777 пар и 574 пар нуклеотидов соответственно. Разработана система транзиентной экспрессии генов GFP и и рчГ-КСФ в растениях in planta при помощи рекомбинантной конструкции Ti-BKKT-GFP и Ti-BKKT-G-CSF, созданные на основе генома ВККТ, с помощью Agrobacterium - опосредованной транзиентной трансформации растений N. benthamiana. Белковая фракция растительных экстрактов изучена методом электрофоретического разделения белков в ПААГ и экспрессия белков подтверждена с помощью Вестерн-блот анализа используя специфические моноклональные антитела к зеленому флуоресцентному белку и гранулоцитарному колониестимулирующему фактору человека.
Достижение технического результата позволяет экспрессировать рекомбинантные белки в растениях за короткий срок.
Текст
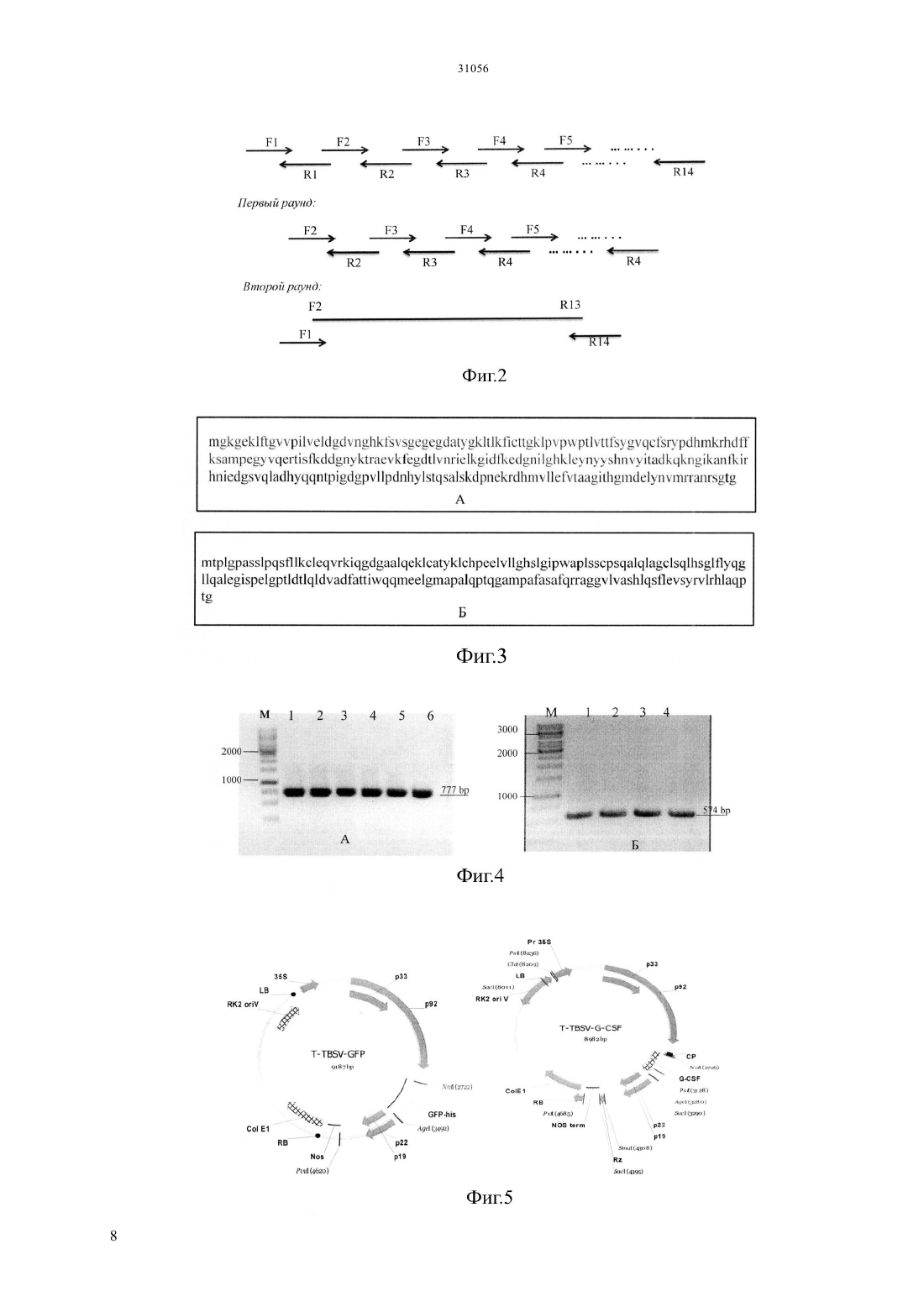
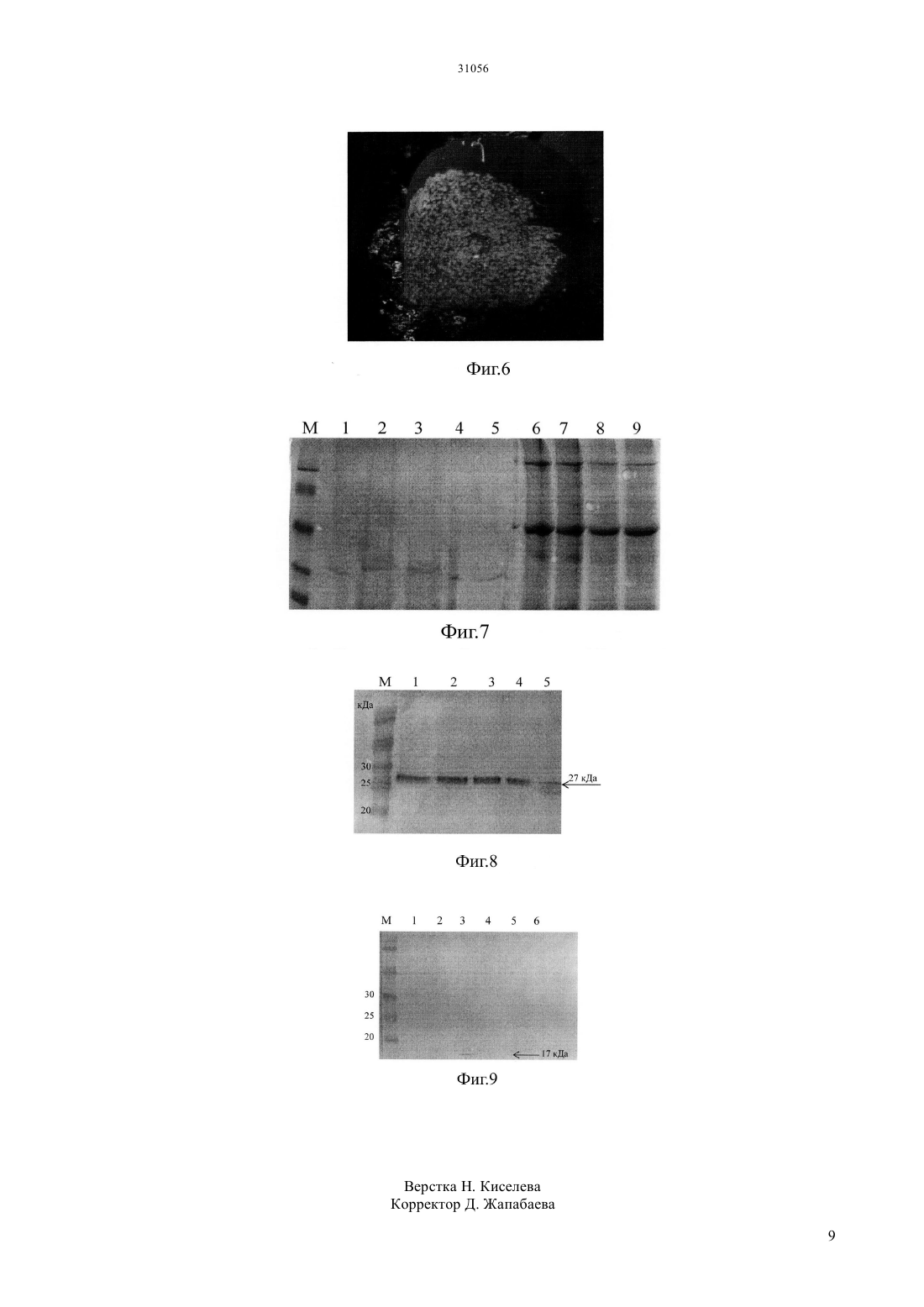
(51) 12 15/82 (2006.01) 12 15/63 (2006.01) 12 15/70 (2006.01) МИНИСТЕРСТВО ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ИННОВАЦИОННОМУ ПАТЕНТУ кодирующих рекомбинантные белки в растениях с помощью вирусного вектора, созданного на основе генома ВККТ. При решении технической задачи синтезируют гены, кодирующие зеленый флуоресцентный белок и гранулоцитарный колониестимулирующий фактор человека, кодон оптимизированные для экспрессии в клетках растений ., длиной 777 пар и 574 пар нуклеотидов соответственно. Транзиентную экспрессию генови рчГ-КСФ в растенияхдостигают при помощи рекомбинантных конструкции -КК- и -КК-,созданные на основе генома ВККТ, с помощью- опосредованной транзиентной трансформации растений Белковую фракцию растительных экстрактов изучают методом электрофоретического разделения белков в ПААГ и экспрессию белков подтверждают с помощью Вестерн-блот анализа, используя специфические моноклональные антитела к зеленому флуоресцентному белку и гранулоцитарному колониестимулирующему фактору человека. Достижение технического результата позволяет экспрессировать рекомбинантные белки в растениях за короткий срок.(72) Манабаева Шуга Аскаровна Абеуова Лаура Сериккызы Раманкулов Ерлан Мирхайдарович(73) Республиканское государственное предприятие на праве хозяйственного ведения Национальный центр биотехнологии Комитета науки Министерства образования и науки Республики Казахстан(54) ТРАНЗИЕНТНАЯ ЭКСПРЕССИЯ ГЕНОВ РЕКОМБИНАНТНЫХ БЕЛКОВИ Г-КСФ ЧЕЛОВЕКА В РАСТЕНИЯХ .(57) Изобретение относится к области генетической инженерии и биотехнологии растений, в частности к способам экспрессии генов рекомбинантных белков в клетках растений и может быть использовано для продукции рекомбинантного зеленого флуоресцентного белка и гранулоцитарного колониестимулирующего фактора человека. Технической задачей изобретения является разработка способа транзиентной экспрессии генов, 31056 Изобретение относится к области генетической инженерии и биотехнологии растений, в частности к способам экспрессии рекомбинантных белков в клетках растений и может быть использовано для экспрессии и продуцирования рекомбинантного гранулоцитарного колониестимулирующего фактора человека. В последние десятилетия в мире непрерывно возрастает спрос на основной продукт промышленной генетической инженерии рекомбинантные белки. К настоящему времени разработаны технологии получения трансгенных растений, в геном которых перенесены гены,кодирующие различные белки для медицинских целей, в том числе и белки человека. Такие технологии основаны на прямом или векторном переносе целевых генов в ядерный геном растения. В ядре рекомбинантная ДНК может быть интегрирована в хромосому или некоторое время существовать во внехромосомном состоянии. Одним из наиболее эффективных методов,позволяющих быстро получить в растениях значительные количества целевого белка, является использование самореплицирующихся рекомбинантных вирусных векторов ( Н. В.,-В. .//. .. - 1996. - . 34. - . 299323.). Идея данного метода состоит в интеграции гена, кодирующего необходимый чужеродный белок, в геном растительного вируса и заражении модифицированным вирусом растительных клеток. При инфекции синтезируются не только собственные белки вируса, но и целевой белок. Продукция рекомбинантного белка в такой системе может достигать до 20 от общего растворимого белка растений ( .,.,.//. - 2007. - . 18. -134-141.). Концепция производства растительной биомассы в качестве материала для биотехнологических процессов актуальна и важна. Использование растений в качестве биофабрик для получения чужеродных белков имеет ряд преимуществ по сравнению с рутинно используемыми системами на основе клеток бактерий,дрожжей и млекопитающих. Во-первых, наработка целевых белков в растениях не требует применения дорогостоящей аппаратуры(ферментеров),культуральных сред и поддержания стерильности. Для роста растений требуется только почва, вода и солнце, поэтому стоимость их выращивания существенно ниже (в 10-30 раз) стоимости культивирования клеток бактерий, дрожжей или животных. Во-вторых,клетки растений биологически безопасны, поскольку растения и человек не имеют общих патогенов. Поэтому продукты, получаемые в растениях, не содержат опасных для человека вирусов и прионов.,М.,.,.//. - 2012. - . 259-274.). В-третьих, в отличие от бактерий и дрожжей,растения и животные имеют сходную систему посттрансляционных модификаций белков ( Н.,,.,//.- 2001. . 6. - . 219-226.). В растительных клетках могут быть получены в природной функциональной форме те белки человека и животных, которые в микроорганизмах нарабатываются только в форме полипептида-предшественника. Гранулоцитарный колониестимулирующий фактор(Г-КСФ) является гемопоэтическим фактором роста, стимулирующим пролиферацию,дифференцировку и созревание гранулоцитов( .//. -1992. - . 17. - . 286-289.). Введение экзогенного Г-КСФ вызывает быстрое,специфичное и дозозависимое увеличение нейтрофилов в периферической крови ( ., Е.-//. - 1985. -.82. - . 1526-1530.,Т.,,., .,.,.,,.-// . - 1995,-. 85.-. 2482-2489.). Производство рекомбинантных аналогов природных белков фармацевтического применения является актуальным для Казахстана. В настоящее время в Казахстане зарегистрированы и имеются в продаже рекомбинантные импортные препараты ГКСФ (Нейпоген, активное вещество-филграстим). Собственного производства цитокинов в Казахстане нет. Высокая стоимость импортных препаратов существенно ограничивает их широкое применение. Использование вирусных векторов для синтеза рчГКСФ в растениях может способствовать значительному снижению стоимости их производства, следовательно, удешевить лечение разных заболеваний, в том числе и онкологических. К настоящему моменту создано множество различных векторных систем на основе вирусов растений различных семейств, которые широко используются как в фундаментальных, так и в прикладных исследованиях ( .,.,.,,. (2006)//. - . 7. - . 203- 217.). В то же время, до сих пор отсутствуют четкие критерии выбора оптимальной векторной системы для экспрессии того или иного целевого белка. В этой связи, интересным является применение генома вируса кустистой карликовости томатов (ВККТ) в качестве автономно реплицирующегося вектора для создания генно-инженерных конструкций,обеспечивающих транзиентную экспрессию рекомбинантных белков в растениях. Наличие в геноме ВККТ гена белка р 19, ингибирующего посттранскрипционное умолкание генов и повышающего уровень экспрессии целевых белков, является существенным преимуществом данной векторной системы. Аналог изобретения. Известны способы получения Г-КСФ, включающие экспрессию в клетках, заключающиеся в быстром биосинтезе клетками бактерий рекомбинантного ГКСФ в виде нерастворимых телец включения(Габибов А.Г., Пономаренко Н.А., Воробьев И.И.,Демин А.В., Мартьянов В.А., Шустер А.М.,Баирамашвили Д.И.,Мирошников А.И. Рекомбинантная плазмидная днк 3-7,кодирующая полипептид с последовательностью гранулоцитарного колониестимулирующего фактора человека, и штамм 21(3)/3-7 - продуцент рекомбинантного гранулоцитарного колониестимулирующего фактора человека / Патент 2260049,, .-. .2006/022878/ 2006.). В этих способах проводят конструирование рекомбинантных плазмидных ДНК, кодирующих конститутивный синтез полипептида со свойствами Г-КСФ человека и штаммы Е. , обеспечивающие синтез этого пептида с уровнем экспрессии 10-30 суммарного клеточного белка. Недостатком этих способов являются, что в бактериальной системе экспрессии эукариотические белки плохо процессируются. Кроме того, необходимым этапом является удаление бактериальных токсинов,присутствующих в данной системе. Известен способ выделения Г-КСФ человека из культуральной жидкости клеточных линий, полученных из опухолевых клеток человека (Оо М.,Н./ 4833127.). Недостатком такого способа является использование опухолевых клеток, низкий выход продукта,вероятность контаминации конечного продукта вирусами человека,невозможность масштабирования процесса выделения и, как следствие, высокая стоимость такого препарата Г- КСФ. Нами не найдено способа транзиентной экспрессии Г-КСФ в клетках растений с использованием вирусного вектора созданного на основе генома вируса кустистой карликовости томата. Известен патент на получение рекомбинантного Г-КСФ в клеточных культурах трансгенных растений табака ( .,М./ 2001075132 2.). Недостатком данного способа получения Г-КСФ является низкий выход продукта,а также необходимость применения дорогостоящей аппаратуры, культуральных сред и поддержания стерильности. Из аналогичных изобретений можно отметить способ получения Г-КСФ в клетках растений с помощью вирусного вектора на основе генома вируса табачной мозаики (ВТМ) (. ., . . , . . , . .. . . (2009)., . 74, . 11, . 11871194) и на основе геномавируса картофеля (ХВК)(Марданова Е.С., Равин Н.В. Вирусный вектор для продукции рекомбинантных белков в растениях // РФ,авторское свидетельство 2402607). Недостаток данных способов геном ВТМ и ХВК не обладают свойством подавлять посттранскипционное умолкание генов (ПТУГ). ПТУГ - защитная противовирусная система растения, основанная на специфичном узнавании и деградации вирусной РНК. Транзиентная коэкспрессия целевого гена с геном белка р 19 из вируса кустистой карликовости томатов (ВККТ) ингибирует посттранскрипционное умолкание генов и повышает уровень экспрессии целевых белков в растениях ( О.,.,.,- 2003. - . 33. -949-956.). Поэтому для стимуляции продуктивности и повышения уровня экспрессии вируса-вектора опыты проводились в условиях совместной агроинъекции смесью агробактерий, несущих геном вируса-вектора и агробактерий, содержащих ген белка р 19 из вируса кустистой карликовости томатов. Отличие предлагаемого нами способа экспрессии рекомбинантных белков в клетках растений от аналогов заключается в применении вектора на основе вируса кустистой карликовости томатов. Вирус кустистой карликовости томатов относится к роду . Геном ВККТ представляет собой РНК позитивной полярности длиной около 4800 нт. Геномная РНК ВККТ содержит пять протяжнных открытых рамок считывания и кодирует пять белков (фиг.1) р 33 и р 92 отвечают за репликацию вируса, и транслируется непосредственно с геномной РНК. р 41 - белок нуклеокапсида вируса, транслируется с субгеномной РНК 1, и участвует в упаковке вирусного генома. Ген белка р 19, известного как супрессора посттранскрипционного умолкание генов и белка р 22, отвечающего за движение вируса транслируются с другой субгеномной РНК 2. Наличие в геноме ВККТ гена белка р 19,ингибирующего посттранскрипционное умолкание генов и повышающего уровень экспрессии целевых белков,является существенным преимуществом данного вирусного вектора. Задача изобретения - разработать способ транзиентной экспрессии генов, кодирующих рекомбинантные белки целевых белков в растениях с помощью вирусного вектора, созданного на основе генома ВККТ. Технический результат, который может быть достигнут с использованием данного способа получения белков в клетках растений - транзиентная экспрессия генов рекомбинантных белков с помощью транзиентной трансформации растенийс вирусного вектора на основе генома ВККТ, который кодирует ген белка р 19, известного как супрессор посттранскрипционного умолкание генов. Белок р 19 является супрессором противовирусной реакции клеток растения-хозяина - умолкания генов в составе вирусной РНК. Эффект ингибирования ПТУГ достигается за счет способности белка р 19 образовывать комплекс с короткими интерферирующими РНК (киРНК), что блокирует систему передачи сигнала ПТУГ. Достижение технического результата позволяет экспрессировать рекомбинантные белки в растениях за короткий срок. В настоящем изобретении ставилась задача создания вирусного вектора на основе ВККТ,который может обеспечивать экспрессию в растенияхи рчГ-КСФ. Фактически задача была решена путем 1) дизайн и синтез генов, кодирующих белкии рчГ-КСФ, с использованием кодонов,оптимальных для их экспрессии в растениях., модифицированные присоединением к ним аминокислотных последовательностей,облегчающих их очистку из растительного материала 2) клонирование синтезированных генов в вирусный вектор на основе генома ВККТ 3) разработка протоколов инфицирования растенияс рекомбинантным вирусным вектором и экспрессия в растениях рекомбинантныхи чГ-КСФ 4) подтверждение факта экспрессии генов,кодирующих белоки рчГ-КСФ, с помощью Вестерн-блот. Первый аспект настоящего изобретения связан с синтезом генов,кодирующих модифицированные белкии рчГ-КСФ, с использованием кодонов, оптимальных для их экспрессии в растениях, модифицированные присоединением к ним аминокислотных последовательностей, облегчающих их очистку из растительного материала. Вторым аспектом изобретения является получение экспрессионных вирусов-векторов,обеспечивающих продукцию в растениях модифицированных белкови рчГ-КСФ. Для этого упомянутые выше синтетические гены были клонированы в вирусный вектор -КК. Соответственно, третий аспект изобретения относится к оптимизации условий инфицирования растенийрекомбинантными вирусами-векторами и последующей экспрессией рекомбинантных белкови рчГ-КСФ в растениях. Четвертый аспект изобретения связан с подтверждением факта экспрессии в растениях белкови рчГ-КСФ в результате Вестерн-блот анализа белков, выделенных из растенийпродуцентов. При этом было показано, что оба рекомбинантных белка, и рчГ-КСФ,действительно синтезируются в листьях растенийпродуцентов и выявлены полосы с молекулярной 4 массой 27 кДа и 17 кДа, соответствовавшие целевым белкам. Осуществление изобретения. Пример 1. Изучение генома вируса кустистой карликовости томата в качестве экспрессионного вектора для растений Для достижения поставленной цели проведен дизайн вирусного генома ВККТ для получения генно-инженерной конструкции, проанализирована последовательность гена кодирующего капсидный белок и сайты, узнаваемые с различными рестриктазами. В результате частичной замены гена БО ВККТ с оптимизированной последовательностью генови рчГ-КСФ в геноме ВККТ получены репликоны ВККТ- и ВККТ-ГКСФ,обеспечивающие транзиентную экспрессиюи рчГ-КСФ в клетках растений. С помощью инокуляции растений . с вирусной РНК ВККТ- проанализирована экспрессия генапод ультрафиолетовой лампой,что является прямым доказательством подтверждения правильной встройкив геном вируса и возможности транзиентной экспрессии данного гена в клетках растений. В результате клонирования репликонов ВККТ- и ВККТГКСФ в бинарный векторполучены вирусные вектора -КК- и Т-ВККТ-ГКСФ, содержащие полный геном ВККТ с генамии рчГ-КСФ,помещенные под контролем сильного конститутивного промотора 35 вируса мозаики цветной капусты обеспечивающий экспрессию генови рчГ-КСФ в растениях. Вирус кустистой карликовости томатов относится к роду. Геном ВККТ представляет собой РНК позитивной полярности длиной около 4800 нт. Геномная РНК ВККТ содержит пять протяжнных открытых рамок считывания и кодирует пять белков р 33 и р 92 отвечают за репликацию вируса, и транслируются непосредственно с геномной РНК. р 41 - белок нуклеокапсида вируса, транслируется с субгеномной РНК 1, и участвует в упаковке вирусного генома. Ген белка р 19,известного как супрессор апосттранскрипционного умолкание генов и белка р 22,отвечающего за движение вируса транслируются с другой субгеномной РНК 2 (фиг.1). До настоящего времени вектор ВККТ был использован для изучения биологии самого вируса,инфекционного потенциала вируса при изменении нуклеотидных последовательностей кодирующих разные вирусные белки или при отключении его генов в лабораторных условиях. Пример 2. Дизайн олигонуклеотидных праймеров для получения нуклеотидных последовательностей генови рчГ-КСФ. Синтез последовательности генови рчГ-КСФДизайн целевых генов и генно-инженерной конструкции на основе генома ВККТ выполняется с использованием пакета программ 11.5(, США). Дизайн генов выполняют с таким расчетом, чтобы открытые рамки считывания имели состав кодонов, оптимальный для их экспрессии в растениях Праймеры рассчитывают с таким перекрыванием, чтобы в дальнейшем использовать их в ПЦР, с температурой отжига 60 С. Для синтеза генов, при расчетах олигонуклеотидных праймеров, праймеры делят на две группы - внутренние и фланкирующие. Внутренние праймеры 100 гомологичный определенному участку рассчитанной последовательности синтезируемого гена,совокупность внутренних праймеров покрывает всю длину гена. При этом чередование внутренних праймеров происходит в порядке Прямой - Обратный - Прямой - Обратный - и т.д. соединения праймеров друг с другом имеют области перекрывания не менее 10 нт. Фланкирующие праймеры предназначены для концов синтезируемого гена и несут уникальные сайты узнавания рестриктаз для последующего клонирования фрагмента ДНК, синтезированного, в плазмидах. Смесь внутренних праймеров используют на-ом раунде ПЦР, продукт которого подвергаютому раунду ПЦР - амплификации, который проводят только с парой фланкирующих праймеров. При проведении ПЦР используют высокоточную полимеразу, США (фиг.2). Клонирование синтезированных фрагментов ДНК, содержащие ген целевого белка,проводят, как описано в лабораторном руководстве( .,,Т.//, - 1987. - 969 .). Подтверждение правильности сборки гена в синтезепроводят путм определения нуклеотидной последовательности ДНК клонированных фрагментов. Секвенирование проводят с использованием наборов 3.1 на автоматическом секвенаторе 3100( , США). Аминокислотная последовательность продуктов экспрессиии и рч-ГКСФ проанализируют и оптимизируют для экспрессии в клетках. (фиг.3). Далее проводят дизайн олигонуклеотидных праймеров для получения кодон оптимизированной нуклеотидной последовательности генови рчГКСФ(таблица 1 и 2). Таблица 1 Последовательности рассчитанных праймеров для синтеза генаКод Последовательности рассчитанных праймеров для синтеза гена рчГ-КСФ Код 1 В результате двухэтапного химического синтезас помощью ПЦР получают гены,кодирующие и рчГ-КСФ кодон оптимизированные для высокоуровневой экспрессии белков в клетках растений . длиной 777 и 574 пар нуклеотидов соответственно,содержащие на концах сайты рестрикциии. Результаты ПЦР второго раунда показаны на фиг.4. Продукты амплификации второго раунда обработают смесью рестриктазии очищают из 1 агарозного геля и в последующем клонируют (лигируют) в вирусный вектор,обработанныйи , созданный на основе генома ВККТ. При этом участок гена белка оболочки перекрывающий субгеномный промотор будет сохранен. Пример 3. Встраивание репликона ВККТ- в. под контролем промотора 35 вируса мозаики цветной капусты Основой для нового вирусного вектора служит вектор . Репликон (фрагмент вирусного генома способного к автономной репликации в пермиссивных клетках) ВККТ- амплифицирует с помощью ПЦР используя праймеры () содержащие сайты рестрикциии , на матрице 7-КК. Далее полученный фрагмент ВККТ с модифицированным геномклонируют в бинарный векторв под контроль сильного конститутивного промотора 35 вируса мозаики цветной капустыпо сайтам рестрикциии , в результате чего получают вирусный вектор Т-ВККТ-. Сконструированный таким образом вирусный вектор -КК- несет полные кодирующие последовательности генома ВККТ с геном ,помещенных непосредственно за эукариотическим промотором 35 вируса мозаики цветной капустыи перед эукариотическим терминатором, что обеспечивает его транскрипцию в эукариотическим геноме (фиг.5). Пример 4. Инфильтрация растений с помощью суспензиинесущую рекомбинантную конструкцию -КК- в условияхТрансфекция вирусных векторов -КК- и Т-ВККТ-ГКСФ в штамм . А 4404 проводят с помощью электропорации. Клоны анализируют на наличие рекомбинантной плазмиды с помощью ПЦР (фиг.5). В результате получают штамм . , несущий вирусный вектор КК-, содержащий полный геном ВККТ с геном , помещенный под контроль сильного конститутивного промотора 35 вируса мозаики 6,обеспечивающий экспрессию КК- в растениях, который используют для агробактериальной инокуляции растений в условиях. Семена . проращивают в горшках,содержащие стандартную почву, при 16 ч фотопериоде(освещение люминесцентными лампами 5 кЛк), при температуре воздуха 28-30 С и 70 относительной влажности воздуха. Затем 2-х недельные проростки рассаживают в отдельные горшки, спустя 4-5 недель, когда растения достигают оптимальную стадию развития, их используют для агроинфильтрации. Для инфильтрации растений используют штамм .4404, несущий вирусные векторы КК- и Т-ВККТ-ГКСФ. Трансформацию клеток .с вирусным вектором КК- и Т-ВККТ-ГКСФ проводят с помощью электропорации. Колоний проверяют с помощью ПЦР на наличие генома ВККТ. Далее отобранные одноклеточные колонии с Т-КК- и Т-ВККТГКСФ культивируют в средеи инкубируют на качалке при 28 С с соответствующими антибиотиками, при перемешивании (220 обо/мин.) в течение 24 часов. Далее 20 млс антибиотиками инокулируют 3 мл ночной культуры и выращивают клетки при тех же условиях до оптической плотности 0,5-0,6 о.е. при длине волны 600 нм. Суспензию клеток центрифугируют в течение 10 минут при 3700 об/мин 40 С. Осадок ресуспендируют в буфере ММА, содержащий 10 мМ( 5,5), 10 мМ 2 и 100 мкМ ацетосирингон, инкубируют минимум один час при комнатной температуре, после чего используют для инфильтрации листьев растений. Заполнение мезофильной ткани листа табака с бактериальной культурой заметно с образованием темно-зеленого сектора. Для того чтобы пропитался весь лист необходимо несколько точек инфильтрации. Инокулированные растения держат при комнатной температуре около суток в защищенном от прямых солнечных лучей месте, создавая относительную влажность. Мониторинг экспрессии генапроводят через 3 дня после инфильтрации подлампой. Генетически модифицированные клетки растений с этим геном светятся в ультрафиолете зеленым светом (фиг.6), затем листья собирают для изучения белковой фракции. Пример 5. Изучение белковой фракции растительных экстрактов методом электрофоретического разделения белков в ПААГ Электрофоретические и иммунохимические методы анализа белков являются одними из наиболее широко применяемых в практике современных исследований белков и полипептидов растений. Наиболее широко при этом применяются электрофоретический анализ денатурированных белков в полиакриламидном геле и вестернблоттинг для выявления индивидуальных белков в полипептидном спектре. Белковая фракция растительных экстрактов изучают методом электрофоретического разделения белков в полиакриламидном геле. Электрофорез проводят в градиенте полиакриламидного геля (415), используя десяти луночные гребенки. Гели окрашивают в теплом растворе красителя (0,04 ный раствор Кумасси -250 в 10-ной уксусной кислоте и 20-ном изопропаноле) и отмывают в 10-ной уксусной кислоте при нагревании (фиг.7). Экспрессию белкаи Г-КСФ проверяют методом Вестерн-блот с помощью специфических моноклональных антител ки Г-КСФ. Для этого изучаемые ткани растения .растирают в ступке в буфере ТЕ в пропорции 100 мг листьев на 100 мкл буфера, затем дважды прокручивают в центрифуге на 10000 оборотов,отбирают супернатант, смешивают в соотношении 101 с буфером для нанесения (50 МТрис,6.8,100 М Дитиотреитол, 0.1 бромфенол синий, 10 глицерол, 2 , содержащей додецилсульфат натрия и бета-меркапто этанола) и кипятят в течение 5-10 минут в кипящей водяной бане. Таким образом,достигается полная денатурация и диссоциация четвертичной структуры. Полученные белки прогоняют в полиакриламидном геле при напряжении 90 в концентрирующем и 120 в разрешающем геле, затем белки переносят на нитроцеллюлозную мембрану при постоянном напряжении 100 и силе тока 260 А в течение 1 часа. Мембраны, после электропереноса белков инкубируют при постоянном перемешивании в течение 30 мин в растворе 7 растворе молока (7.0 грамм порошок обезжиренного молока,1 ХТБС/твин-20 50 МТрис, 200 , 500 1 Твин-20) для блокировки мест возможного неспецифического связывания антител. Затем мембраны инкубируют в течение 1 часа с первичными антителами противи Г-КСФ продуцированные в мышах, которые растворяют в ТБС/твин, содержащий 7-ное сухое молоко. По окончании инкубации мембраны промывают 3 раза буфером ТБЕ/твин, и переносят в раствор вторичных антител (антитела против антител мыши, конъюгированныес щелочной фосфатазой). В растворе вторичных антител, при разведении 12000,мембраны инкубируют час при постоянном перемешивании. Затем мембраны отмывают 3 раза по 10 минут и визуализируют с помощью фосфатного буфера содержащий 5-бром-4-хлор-3 индолил фосфати нитро синий тетразол и рч-ГКСФ подтверждают с помощью Вестерн-блот анализа, с помощью специфических моноклональных антител к зеленому флуоресцентному белку и рекомбинантному гранулоцитарному колониестимулирующему фактору человека (фиг.8 и 9). Полученные результаты демонстрируют, что использованный способ экспрессии генов в растениях и апробированный метод оценки эффективности экспрессии,основанный на использовании агроинфильтрации листьев табака,позволяет с высокой достоверностью предсказать эффективность систем транзиентной экспрессии генов, кодирующих рекомбинантные белки в растениях при использовании вирусного вектора,созданного на основе генома вируса кустистой карликовости томатов. ФОРМУЛА ИЗОБРЕТЕНИЯ Транзиентная экспрессия генов рекомбинантных белкови Г-КСФ человека в растениях., включающаяопосредованную транзиентную трансформацию растений, отличающаяся тем, что синтез генов,кодирующих рекомбинантные белки проводятс использованием кодонов,оптимальных для их экспрессии в растениях., экспрессионные вирусные векторы получают на основе генома вируса кустистой карликовости томатов, подтверждение факта экспрессии генов, кодирующих белкии рчГКСФ проводят с помощью иммуноблоттинга,используя специфические моноклональные антитела к зеленому флуоресцентному белку и рекомбинантному гранулоцитарному колониестимулирующему фактору человека.
МПК / Метки
МПК: C12N 15/82, C12N 15/70, C12N 15/63
Метки: генов, экспрессия, растениях, рекомбинантных, n.benthamiana, человека, г-ксф, транзиентная, белков
Код ссылки
<a href="https://kz.patents.su/9-ip31056-tranzientnaya-ekspressiya-genov-rekombinantnyh-belkov-gfp-i-g-ksf-cheloveka-v-rasteniyah-nbenthamiana.html" rel="bookmark" title="База патентов Казахстана">Транзиентная экспрессия генов рекомбинантных белков GFP и Г-КСФ человека в растениях N.benthamiana</a>
Предыдущий патент: Способ диагностики меланомы у собак
Следующий патент: Способ подбора дозы Варфарина больным казахской национальности с фибрилляцией предсердий
Случайный патент: Колонковый снаряд для бурения скважин с гидротранспортом керна