Способ мониторинга микробиологического загрязнения овощей на стадиях выращивания и хранения
Номер инновационного патента: 23667
Опубликовано: 15.02.2011
Авторы: Титова Ираида Владимировна, Агыбаева Ақмарал Бейсенкуловна, Велямов Масимжан Турсунович, Магажанов Жастлек Мусагалиевич
Формула / Реферат
Изобретение относится к области микробиологии, а именно переработки пищевой промышленности, и может быть использовано для микробиологического мониторинга овощей на стадиях выращивания и хранения.
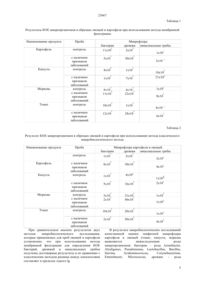
Технический результат достигается тем, что способ мониторинга микробиологического загрязнения овощей на стадии выращивания и хранения, включающий отбор опытного образца картофеля и овощей (капуста, морковь, томат) здоровых и с наличием признаков заболевания в полевых условиях на стадиях их выращивания и хранения, подготовки из них проб для исследований, посева на микробиологические среды для выявления количества колониеобразующих единиц (КОЕ) бактерий, дрожжей и мицелиальных грибов с идентификацией их до родов, проводится уско-ренным способом, при этом подготовленные разведения проб пропускают через готовые стерильные питательные картонные подложки, установленые в фильтрационной системе, которые выбирают в зависимости от типа определяемых микроорганизмов, при этом для определения бактерий используют сухие питательные картонные подложки «Стандарт ТТС» марки SM 14055-050N, a для определения дрожжей и мицелиальных грибов- «Saburaund» марки SM 14069-050N, после чего их помещают в чашку Петри и инкубируют в термостате 24-30 часов при 30°С, контролируя процесс роста колоний после 24 часов, через каждые 2 часа и производят подсчёт КОЕ микроорганизмов с последующей идентификацией их до родов направленных для разработки эффективных предупреждающих мероприятий в процессе выращивания и в период хранения картофеля и овощей для получения качественной и безопасной продукции.
Текст
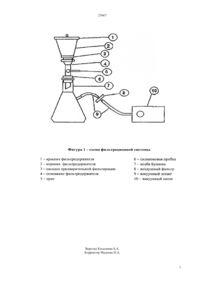
(51) 23 3/00 (2009.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ИННОВАЦИОННОМУ ПАТЕНТУ наличием признаков заболевания в полевых условиях на стадиях их выращивания и хранения,подготовки из них проб для исследований, посева на микробиологические среды для выявления количества колониеобразующих единиц (КОЕ) бактерий, дрожжей и мицелиальных грибов с идентификацией их до родов, проводится ускоренным способом, при этом подготовленные разведения проб пропускают через готовые стерильные питательные картонные подложки,установленые в фильтрационной системе, которые выбирают в зависимости от типа определяемых микроорганизмов, при этом для определения бактерий используют сухие питательные картонные подложки Стандарт ТТС марки 14055-050,для определения дрожжей и мицелиальных грибов марки 14069-050, после чего их помещают в чашку Петри и инкубируют в термостате 24-30 часов при 30 С, контролируя процесс роста колоний после 24 часов, через каждые 2 часа и производят подсчт КОЕ микроорганизмов с последующей идентификацией их до родов направленных для разработки эффективных предупреждающих мероприятий в процессе выращивания и в период хранения картофеля и овощей для получения качественной и безопасной продукции.(72) Велямов Масимжан Турсунович Магажанов Жастлек Мусагалиевич Титова Ираида Владимировна Агыбаева Амарал Бейсенкуловна(73) Товарищество с ограниченной ответственностью Казахский научноисследовательский институт перерабатывающей и пищевой промышленности(56) Кудряшева А.А. Микробиологические основы сохранения плодов и овощей, М. Агропромиздат,1986, с. 192(54) СПОСОБ МОНИТОРИНГА МИКРОБИОЛОГИЧЕСКОГО ЗАГРЯЗНЕНИЯ ОВОЩЕЙ НА СТАДИЯХ ВЫРАЩИВАНИЯ И ХРАНЕНИЯ(57) Изобретение относится к области микробиологии, а именно переработки пищевой промышленности, и может быть использовано для микробиологического мониторинга овощей на стадиях выращивания и хранения. Технический результат достигается тем, что способ мониторинга микробиологического загрязнения овощей на стадии выращивания и хранения,включающий отбор опытного образца картофеля и овощей (капуста, морковь, томат) здоровых и с 23667 Изобретение относится к области микробиологии, а именно переработки пищевой промышленности, и может быть использовано для микробиологического мониторинга овощей на стадиях выращивания и хранения. Задачей изобретения Способ мониторинга микробиологического загрязнения овощей на стадиях выращивания и хранения является новый ускоренный способ проведения мониторинга микробиологического загрязнения овощей на стадии выращивания и хранения для внедрения в инновационную практику в области микробиологии,а именно переработки пищевой промышленности. Известен способ микробиологического мониторинга овощей, на примере картофеля,моркови, томата и капусты, при котором используются классические питательные среды для определения количества колониеобразующих единиц (КОЕ) микроорганизмов, в частности, среда мясопептонный агар (МПА) для выделения бактерий, сусло агар (СА) для выделения дрожжей и мицелиальных грибов(Кудряшева А.А.Микробиологические основы сохранения плодов и овощей, М.Агропромиздат,1986.-с. 192). Недостатком этого способа является то, что для проведения исследований затрачивается длительное время. При этом для подготовки среды,стерилизации посуды (чашки Петри, колбы,пипетки, пробирки и т.д.) необходимо 3-5 дней,затем в условиях бокса делаются посевы на стерильные чашки Петри (на 1 пробу используются 20 чашек и более), в течение 3 и более часов, а для определения КОЕ и идентификации их до родов требуется ещ 3-6 дней, т.е. в целом на вес процесс проведения опыта затрачивается от 6(для бактерий) до 11 дней (для дрожжей и грибов). Таким образом, данный метод продолжительный и трудоемкий. К тому же качество и стандартность питательных сред не соответствует международным стандартным требованиям, в частности, что указывает на то, что данный способ не обеспечивает высокое качество и воспроизводимость каждого опыта. К тому же при постановке опытов с использованием классических питательных сред не всегда наблюдается рост микроорганизмов, так как в процессе засева образцов нет возможности устранения веществ,задерживающих рост микроорганизмов,то есть ингибиторов. Следовательно, указанный метод не является экспресс методом. При этом данный метод является энергозатратным, так как в процессе подготовки необходимых ингредиентов, стерилизации посуды и питательных сред для проведения опыта идут большие траты электроэнергии. Техническим результатом изобретения является предложение более эффективного, экономически менее затратного и ускоренного способа микробиологического мониторинга овощей на стадиях выращивания и хранения с целью определения качества продукции за счт меньшей затраты времени и электроэнергии при постановке опыта, т.е. на подготовку питательных сред не затрачивается время, так как они готовые, а для выявления бактерий необходимо 2 дня , дрожжей- 23 дней, и мицелиальных грибов -4 дней и в целом на вес процесс проведения опыта затрачивается от 2(для бактерий) до 4 дней(для дрожжей и грибов) точностью обнаружения легкостью подсчета колоний на фильтрах готовностью фильтров и питательных подложек к немедленному применению устранением веществ, задерживающих рост микроорганизмов простотой и длительностью хранения питательных подложек качеством соответствующее международным требованиями возможностью документирования и сохранения полученных результатов. При постановке опыта известным классическим способом микробиологического исследования делается соскоб с поверхности овощей в количестве 1 грамма, либо с поверхности 1 см 3 ,гомогенизируется, переносится в 99 мл стерильной водопроводной воды,все тщательно перемешивается в течение 20 минут на механическом встряхивателе. Затем,после отстаивания (в течение 2 минут) делаются последовательные разведения в пробирках с 9 мл стерильной воды, перенося по 1 мл суспензии из одной пробирки в другую стерильными градуированными пипетками. После чего, проводится глубинный посев на среду МПА (мясо-пептонный агар) для подсчета КОЕ и выявления бактерий, на среду СА (суслоагар)-для подсчета КОЕ и выявления дрожжей и мицелиальных грибов. Технический результат предлагаемого микробиологического анализа достигается тем, что способ мониторинга микробиологического загрязнения овощей на стадии выращивания и хранения, включающий отбор опытного образца картофеля и овощей (капуста, морковь, томат) здоровых (контроль) и с наличием признаков заболевания (опытный) в полевых условиях на стадиях их выращивания и хранения, подготовки из них проб для микробиологических исследований,посева на микробиологические среды для выявления количества колониеобразующих единиц бактерий,дрожжей и мицелиальных грибов с определением их до родов, проводится ускоренным способом, при этом подготовленные разведения проб пропускают через готовые стерильные питательные картонные подложки,установленые в фильтрационной системе, которые выбирают в зависимости от типа определяемых микроорганизмов, при этом для определения бактерий используют сухие питательные картонные подложки (ПКП) Стандарт ТТС марки 14055-050 ,для определения дрожжей и мицелиальных грибов марки 14069-050, после чего их помещают в чашку Петри и инкубируют в термостате 24-30 часов при 30 С, контролируя процесс роста колоний после 24 часов, через каждые 2 часа и производят подсчт количества колониеобразующих единиц микроорганизмов с последующей идентификацией их до родов. 2 23667 Этот метод имеет ряд преимуществ по сравнению с другими, в частности Возможность контроля проб с низким содержанием микроорганизмов(пропускание больших объемов проб). Все микроорганизмы,содержащиеся в пробе, задерживаются на мембранном фильтре.- Различный цвет фильтра и наличие контрастной сетки обеспечивают оптимальный контраст светлых и прозрачных колоний, что облегчает подсчет числа колоний на фильтре.-Фильтры и питательные подложки предварительно простерилизованы и индивидуально упакованы,которых можно в любое время использовать для работы.-Ингибирующие субстанции микроорганизмов вымываются из мембранного фильтра в процессе фильтрации, что ускоряет и облегчает их рост.-Сухая стерильная форма питательной среды в картонных подложках позволяет хранить их в сухом темном месте от 9 до 24 месяцев.-Мембранные фильтры и картонные подложки с питательной средой производятся с учетом требований , что обеспечивает высокое качество и гарантирует воспроизводимость каждой партии и внутри одной и той же партии.-При необходимости мембранный фильтр после высушивания сохраняется в качестве доступного исследуемого документа.-Данный метод является экспресс - методом, так как затрачивается меньше времени на предварительную подготовку к опыту, нет необходимости готовить заранее питательные среды, следовательно, меньше затрачивается времени и электроэнергии для исследовательских работ по сравнению с классическим методом. Способ осуществляется следующим образом отбираются образцы овощей (картофель, морковь,капуста, томат) здоровые (контроль) и с наличием признаков заболевания (опытные) в полевых условиях хозяйств в стадии выращивания или в период хранения. Подготовка пробы при данном способе микробиологического исследования на первом этапе аналогична классическому делается соскоб с поверхности овощей в количестве 1 грамма,гомогенизируется, переносится в 99 мл стерильной водопроводной воды,все тщательно перемешивается в течение 20 минут на механическом встряхивателе. Затем,после отстаивания (в течение 2 минут) делаются последовательные разведения в пробирках с 9 мл стерильной воды, перенося по 1 мл суспензии из одной пробирки в другую стерильными градуированными пипетками. Предварительно готовится к работе фильтрационная система, которая состоит из фильтродержателя,насадки предварительной фильтрации, силиконовой трубки, колбы Бунзена,вакуумного шланга, воздушного фильтра и электрического вакуумного насоса. При этом подготовку фильтрационной системы к работе проводится согласно данной схеме 1) Фильтродержатель необходимо очищать перед первым применением и после каждой фильтрации 2) Разобрать фильтродержатель 3) Очистить все части мягкой щеткой теплой водой, синтетическим стиральным порошком 4) Ополоснуть сначала горячей, а затем дистиллированной водой 5) Высушить все части и простерилизовать 6)Собрать фильтрационную систему (согласно фиг. 1). При этом металлическая часть фильтродержателя стерилизуется завернутой в бумагу при температуре не более 180 С в течение 30 минут. Далее опыт проводится с соблюдением правил асептики. Для проведения опыта из специальных упаковок вынимается необходимое количество чашек Петри с ПКП. В каждую чашку,приоткрыв е с одной стороны, вносится по 3,25 мл стерильной воды (медленно в центр ПКП,дозирующим шприцем(М 13806),через фильтровальную насадку Минисарт). После, чего стерильный мембранный фильтр вместе с защитным желтым листом вынимают из упаковки при помощи пинцета и ложится защитным листком вверх на фритту фильтродержателя при снятой воронке и насадке предварительной фильтрации, затем включают вакуумный насос (фильтр при этом плотно притягивается к фритте) и убирают защитный листок. После, чего надевают насадку предварительной фильтрации и фиксируют е зажимом. При перекрытом кране фильтрационной установки заполняют приставку доверху стерильной водой и устанавливают на фритту приставки мембранный префильтр. Надевают воронку и фиксируют е зажимом. Во время фильтрации грубые частицы задерживаются на перефильтре, а микроорганизмы беспрепятственно проходят и равномерно оседают на мембранном фильтре. Затем,по 1 мл пробы каждого разведения перед фильтрованием разбавляют в пробирках 10 мл стерильной воды. После чего, фильтрование проб начинают с наибольшего разведения (11 000).В последующем при перекрытом кране фильтрационной установки осторожно переносят пробу на префильтр (без забрызгивания и переливания за края воронки). Промывают пробирку 10 мл стерильной водой (в два приема по 5 мл), и содержимое так же переносят в воронку. Закрывают воронку крышкой и открывают кран установки. После отсасывания пробы необходимо внести воронку спиралевидным движением (от краев к середине) 20 мл стерильной воды (при этом смываются остатки пробы со стенок воронки, и фильтр промывается для удаления возможных ингибиторов роста). Затем, снимают воронку,удаляют мембранный префильтр с фритты насадки предварительной фильтрации и продолжают фильтрование через нижний мембранный фильтр до прекращения капания воды в колбу Бунзена. После завершения фильтрования перекрывают кран,снимают насадку предварительной фильтрации и пинцетом удаляют мембранный фильтр с фритты. Затем, мембранный фильтр немедленно помещают в 3 23667 чашку Петри на предварительно смоченную стерильной водой ПКП так, чтобы под ним не было пузырьков воздуха. Чашки Петри с мембранными фильтрами переворачивают так, чтобы ПКП оказались сверху, и ставят в термостат на 24-30 часов при 30 С. Контролировать процесс роста колоний после 24 часов инкубации через каждые 2 часа. Перерастание колоний приводит к затруднению подсчета, так как происходит их слияние. Считают выросшие колонии, не вынимая фильтры из чашек. Чтобы определить КОЕ в анализируемом образце, следует умножить число выросших колоний на фильтре на соответствующее разведение. Для получения чистых культур и идентификации микроорганизмов можно произвести пересев выросших колоний на чистые фильтры в новых чашках ПКП или на стандартные агаровые или жидкие среды. Если необходимо документировать результаты исследования, то фильтры следует вынуть из чашек и высушить на воздухе, на листе картона. Важно избегать пересушивания фильтров,они при этом сворачиваются и становятся хрупкими. Высушенные фильтры наклеивают на протокол исследования и используют для отчетности. Идентификацию до рода бактериальной,дрожжевой и грибной микрофлоры, выделенную с поверхности картофеля и овощей, проводят в соответствии с определителями бактерий, дрожжей и мицелиальных грибов(Определитель бактерий Берджи, 9-е изд. в 2-х т. /Дж. Хоулт, Н. Криг, П. Снит, Дж. Стейли, С. Уильмс. /Пер. с англ. под ред. акад. РАН Г.А. Заварзина. М. Мир, 1997, т.1. - 432 с,т.2. - с. 368 Красильников Н.А. Определитель бактерии и актиномицетов. М. Л., АНСССР, 1949 с.201). Пример 1 Для изучения пригодности указанного способа для проведения мониторинговых исследований степени обсемененности микроорганизмами овощей, с начало опыты проведены только лишь с картофелем. При этом, как указано выше делали смыв с поверхности пробы, перемешивали в течение 20 минут на механическом встряхивателе, затем пробу отстаивали и делали последовательные разведения. Готовили к работе фильтрационную систему и проводили фильтрования предварительно разведенных проб. В данном случае для выявления КОЕ мезофильных, аэробных и факультативных анаэробных бактерий использовали ПКП Стандарт ТТС 14055-050, а для дрожжей и мицелиальных грибов ПКП( 14069-050 ). После чего, пинцетом мембранный фильтр помещали в чашку Петри на предварительно смоченную стерильной водой ПКП так, чтобы под ним не было пузырьков воздуха. Чашки Петри с уложенными в них мембранными фильтрами инкубировали в термостате 24-30 часов при 30 С. Процесс роста колоний контролировали после 24 часов инкубации через каждые 2 часа. В результате микробиологических исследований картофеля установлено,что микрофлора представлена бактериями,дрожжами и мицелиальными грибами. В пробах картофеля вышеуказанным способом установлено, что КОЕ бактерий в среднем составляет в здоровых образцах 1106, а с наличием признаков заболевания 19106, КОЕ дрожжей 2 х 106 и 25103, а КОЕ мицелиальных грибов 3102 и 1103,соответственно. Для сравнения были использованы традиционные микробиологические методы глубинный посев на чашки Петри на стандартные среды МПА (мясо- пептонный агар) - при выделении бактерий, на Сусло агар - при выделении дрожжей и мицелиальных грибов. В данном случае определяли количество КОЕ. При микробиологическом исследовании здоровых и с наличием признаков заболевания образцов картофеля традиционным методом посева на агаризованную питательную среду, выяснено, что КОЕ бактерий в среднем составляет 1103 и 8104,соответственно, КОЕ дрожжей - 2103 и 3010 , а мицелиальных грибов - 210 и 410 ,соответственно. Как видно из представленных выше результатов,показатели при мембранной фильтрации в среднем на 21 выше, чем при использовании классического метода. Следовательно, способ мембранной фильтрации вполне можно использовать при проведении мониторинговых исследований картофеля, на микробиологические загрязнения. Пример 2 В процессе отработки микробиологического метода мембранной фильтрации определен количественный состав эпифитной микрофлоры в здоровых (контроль) и с наличием признаков заболеваний в образцах овощей (моркови, капусты,томата) и картофеля, результаты которых представлены в таблице 1. 23667 Таблица 1 Результаты КОЕ микроорганизмов в образцах овощей и картофеля при использовании метода мембранной фильтрации Наименование продукта с наличием признаков заболеваний контроль с наличием признаков заболеваний контроль с наличием признаков заболеваний контроль Микрофлора дрожжи мицелиальные грибы 2 2 х 10 1101 30 х 10 110 710 Таблица 2 Результат КОЕ микроорганизмов в образцах овощей и картофеля при использовании метода классического микробиологического метода Наименование продукта с наличием признаков заболеваний контроль с наличием признаков заболеваний контроль с наличием признаков заболеваний контроль с наличием признаков заболеваний При сравнительном анализе результатов двух методов микробиологического исследования,которые применялись для проб овощей и картофеля установлено, что при использовании метода мембранной фильтрации для определения КОЕ бактерий, дрожжей и мицелиальных грибов получены достоверные результаты и по сравнению с классическим методом разница между показателями составляет в пределах одного . Микрофлора картофеля и овощей бактерии дрожжи мицелиальные грибы 3 3 1 х 10 2 х 10 2101 8 х 10 1 х 10 5 х 10 В результате микробиологических исследований качественной оценки эпифитной микрофлоры картофеля и овощей (томат, капуста, морковь выявляются нижеследующие роды микроорганизмов бактерии - рода , , дрожжи рода 5 23667 мицелиальные грибы- рода ,. Таким оброзом,нами установлено,что проведение мониторинговых исследований микробиологического загрязнения продукции растениеводства, в частности, картофеля и овощей(капуста, морковь, томат) на стадиях выращивания и в период хранения необходимо для разработки эффективных предупреждающих мероприятий для получения качественной и безопасной продукции. Микробиологический анализ, основанный на мембранной фильтрации проб с применением стерильных питательных сред и сухих питательных подложек вполне пригоден для мониторинговых микробиологических исследований овощей и картофеля в период их выращивания и хранения. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ мониторинга микробиологического загрязнения овощей на стадии выращивания и хранения, включающий отбор опытных образцов картофеля и овощей здоровых и с наличием признаков заболевания в полевых условиях на стадии их выращивания и в период хранения,подготовки из них проб для микробиологических исследований, посева на микробиологические среды для выявления количества колониеобразующих единиц бактерий, дрожжей и мицелиальных грибов с определением их до родов, отличающийся тем,что для ускоренного изучения обсемененности микроорганизмами овощей,подготовленные разведения проб пропускают через готовые стерильные питательные картонные подложки,установленные в фильтрационной системе, которые выбирают в зависимости от типа определяемых микроорганизмов, при этом для определения бактерий используют питательные картонные подложки Стандарт ТТС марки 14055-050, для определения дрожжей и мицелиальных 6-марки 14069-050 Тч,после чего их помещают в чашку Петри и инкубируют в термостате 24-30 часов при 30 С, контролируя процесс роста колоний после 24 часов, через каждые 2 часа и производят подсчт количества колониеобразующих единиц микроорганизмов с последующей идентификацией их до родов.
МПК / Метки
МПК: A23L 3/00
Метки: овощей, микробиологического, мониторинга, способ, стадиях, загрязнения, выращивания, хранения
Код ссылки
<a href="https://kz.patents.su/7-ip23667-sposob-monitoringa-mikrobiologicheskogo-zagryazneniya-ovoshhejj-na-stadiyah-vyrashhivaniya-i-hraneniya.html" rel="bookmark" title="База патентов Казахстана">Способ мониторинга микробиологического загрязнения овощей на стадиях выращивания и хранения</a>
Предыдущий патент: Химический состав и способ извлечения нефти из углеводородного пласта
Следующий патент: Устройство для удаления сердцевины плодов, преимущественно арбузов
Случайный патент: Диетический мармелад "Руслан"