1-(2-Этоксиэтил)-3е-метил-4а-оксипиперидин в качестве промежуточного соединения в синтезе гидрохлоридов 1-(2-этоксиэтил)-3е-метил-4а-ацилоксипиперидинов, обладающих местноанестизирующей активностью
Номер патента: 3143
Опубликовано: 15.03.1996
Авторы: Ю Валентина Константиновна, Пралиев Калдыбай Джайловович, Шин Светлана Николаевна, Тараков Сатыбалды Амирбекович, Игнатов Юрий Дмитриевич, Васильев Юрий Николаевич
Формула / Реферат
Изобретение касается замещенных пиперидина, в частности 1-{2-этоксиэтил}-Зе-метил- 4а-оксипиперидина - полупродукта в синтезе его гидрохлорида, обладающего местноанестезирующей активностью, что может быть использовано в медицине. Цель - создание нового полупродукта для указанного назначения. Синтез ведут реакцией 1-[2-этоксиэтил}-4-кетопиперидина с боргидридом натрия в изопропаноле при 55°С. На индивидуальные стериоизомеры разделяют раскристаллизацией фумаратрв из ацетона. Выход 28,8%. брутто-ф-ла: C10H21NO2.5 табл.
Текст
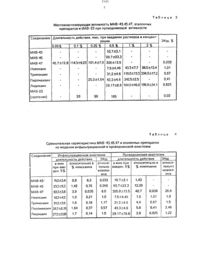
стереоизомерных спиртов с Н 0.09 и.О,25. Разделение СМССИ СТЗОВОИЗОМВООВ СПИОТОВч на индивидуальные формы проводят на ко лонке с окисью алюминия (Н степень активности), элюентэфишгексан - 21. ПолучаютСтроение синтезированного 1-(2-атоксиэтил)-3 е-метил-4 а-оксипиперидина (1) устанавливали на основанди данных ИК-спектров и спектров ЯМР С. Спектры ЯМРЮС соединения 1 и его эпимера -1-(2 этокси-этил)3 е-метил-4 е-оксипиперидин,полностью соответствуют ихлредполагаемому составу. Отнесение сигналов атомов углерода проводили по спектрам ЯМРЮСс частичной развязкой от протонов.Химические сдвиги атомов углерода пиперидолов-4 приведены в табл.1.Как видно из табп.1, стереоизомеры отличаются друг от друга ориентацией заместителеи при Сд пиперидинового цикла. Об этом свидетельствуют значения химическихсдвигов атомов углерода С 2,С 4.Св. Так бо лее сильнопольныи сдвиг сигнала Сц соеди 4 ения 1 (679 м.д.) указывает на аксиальнуюэриентацию гидроксильной группы по срав-нению с его эква гориальным эпимером (74,2 м.д.). Аналогичные закономерности в значениях химических сдвигов атомов С 2 и. Св этих соединений также говорят об экваториальной ориентации гидроксильной группы в П и аксиальной - в -. Анализ данных ИК спектров подтверждает приписанную ори ентацию гидроксильной группы. Полоса поглощения ОН-группы в спирте 1 наблюдается при 3620 см по сравнению с 3615 см 1 в его зпимере. что указывает на-аксиальную ОН-группу в . .у . П р и м е р 2. 1-(2-Этоксизтил)-3 е-метил да-оксипиперидин (1). К 5,42 г (0.081 моль) изопропилата алюминия в 300 мл изопропанола при перемешивании-добавляют 15 г(0,081 моль) 1-(2-этоксизтил)-3-метил-4-кетопиперидина в 100 мл изопропанола с одновременной отгонкой смеси ацетона. образующегося в процессе реакции, и изопропанола. После окончания прикапывания кетона. отгонку смеси продолжают еще 30 мин. Затем к охлажденному раствору добавляют НС 1.(11) до рН 3. подщепачивают реакционную смесь насыщенным растворомМаОН до рн 10. продукт многократно экс трагируютэфиром. Эфирный экстракт сушат сульфатом магния, отфильтровывают осушитель. упаривают эфир. Выход смеси 95 (14,42 г).тиз которой выделено 8.5 г (56,О от теоретического. 59,1 Д, от смеси изомеров,(0.0106 моль) спирта 1 в 10 мл (0106 моль) уксусного ангидрида прибавляют 8 мл (О. 106 моль) хлористого ацетила. при этом наблюдается разогревание реакционного раствоура. Раствор оставляют п-ри комнатной температуре втечение 24 ч. Избыток реагентов отгоняют. остаток перекристалпизовывают из метилэтилкетона, получают 2,03 гП р и м е р 4. Гидрохлорид 1-(2-этокси- этил)-3 е-метил-4 а-пропионилоксипиперидина(Пб). К раствору 2 г(0.0106 моль)спирта 1 в 13,5 мл (0,10 б моль) пропионового ангидрида прибавляют 9.2 мл (0106 моль) хлористого пропионила. При этом наблюдается разогревание реакционной. смеси. Смесь оставляют при комнатной температуре в течение 24 ч. Отгоняют избыток реагентов. Остаток перекристаллиэовывают из метилэтилкетона, получают гидрохлорид Н 2-этоксиэтиЩ-Зе-метил-да-пропионипоксипиперидина (Пб) в количестве 2.43 г (82.1 от теореттеского), т.пл. 180181 С. Пг 0,72.(Па). К 2 г (00106 моль) спирта 1 прилипают 1,2 мл (00308 моптфхлористого бензоила. При этом наблюдается разогревание. по мере остывания смеси затустевает и образуется твердая стекловидная масса. которую перекристаллизозывают из метилэтилкето на и получают 3.29 г (94.8 от теоретического) гидрохлорида 1-(2-этоксизтил)-3 е-метил-4 абензоилоксипиперидина (Нв) т.пп. 183-484 С П 0.63, НайденоНЪ С 62.48 Н 8.10 М 4.71 С 10.80.(МАВ 47. Пе). полученные из соединения . испытаны на местоанестезирующую активность и острую токсичность на кафедре фармакологии .1 го Ленинградского медиЦИНСКОГО ИНСТИТУТЭ.ТЕЭМИНЗЛЬНЭЯ ЗНВСТВЗИЯ ИЗУЧЗЛЭСЬ нароговице глаз кроликов по методике Ренье. инфильтрационная при подкожном введении препаратов морским свинцам по мето л дике БюльбрингггУэйда. проводниковая. наобнаженных седалищных нервах по методи.ке Искарева. Острая токсичность определя лась на белых мышах обоего пола. массой 165-22 г при внутрибрюшинном и подкожном введении. .Активность и токсичность соединений сравнивалась с аналогичными параметрами новокаина. тримекаина. пиромекаина и лидокаина и гидрохлорида 1-(2-этоксиэтил)-4 этилил-д-бензоилоксипиперидина (МАВ-2 З) по показателям длительность анестезии. Экзов иЛДювмг/кг.МАВ-ЧЗ и 45 не проявляют активность на модели терминальной анестезии. МАВ 47 в БЗЬ-ном растворе вызывает терминальную анестезию продолжительностью 50.6 мин (табл.2). Эталонные препараты приданном-виде анестезии также не активны. Продолжительность действия МАВ 23 в 5 растворе равна 5.мин.При инфильтрационной анестезии МАВ-43 и 45 проя.вили активность в концентрации 0,5. МАЕ-д вызывает инфильтрационную анестезию уже в 0,1 растворе. В 05 растворе продолжительность действия МАВ-дз равна 15.0, МАВ 45 23.3 и МАЕ-дБ - 23.3 и МАВ 47 63.3 мин. в то время как этот показатель у эталонных препаратов колстпется в пределах 163-312 мин. МАВ-З в- этой концентрации действует в течиние 15 мин. По показателю ЭК 5 оМАВ-4 З и 45 уступают эталонным препаратам и МАВ-23. МАВ 47 превосходит новокаиштримекаин. пиромекаин. лидокаин, а также и мАв-гз в б. 5.1.10. 6. 4 и 3.4 раза(00176). в то время как утэталонных препаратов аналогичнаяактивностьпоявляется тв 0.5 и 1 (новокаин) растворах. В 0,5 рас творе МАЕ-А действует в течение 305 мин.Эталонные препараты в этой концентрации действуют а течение 6 7543.3 мин. Продолжительность действия- МАВ 2 З равна 165 мин (О 5). По показателю ЭКЮ. МАЕ-д превосходит эталонные препараты в 26.6Данные по проводниковой анестезии при ведены втабл.3. В табл. 4 приведена сравнительнаяхарактеристика МАВ 34 З. 45 и 47 эта лонных препаратов по ттоказатпяминфилЪтрационной и проводниковой ане стезии относительно новокаина. . Прианализе токсичности (Лдэо) оказа лось. что МАВ-43 и 45 и внутрибрюшинномвведении менее токсичны эталонных препаратов (табл,5) и МАВ-23 МАВ-47 равен по токсичности пиромекаину (в/бр, менее токсичен. чемтлидокаин иуступает новокаину, тримекаину и-МАВ 23 при подкожном ввеч дении он менее токсичен чем пиромекаин илидокаин. но уступает новокаину и тримека единения вещества МАВ 4345 и 47 проявляют местноанестеаириюущую активность. МАВ 47 по изученным показателям превышает по активности эталонные препараты. проявляя равную или чуть большую токсичность. Причем. при интрафильтрационной анестезии МАВ-47 по ЭК 5 о превышает эталонные препараты в 51-1 О.б раз. при проводниковой - в 10.826.6 раз. уступая по токсичностипри в/бр введении тримекаину в 1.3 раза. а при п/к введении уступает новокаину в 1.98 раз. Аналогу по структуреМАЕ-д уступаетпо токсичности, при тер минальной анестезии МАВ-П по продолжительности действия превосходит МАВ 23 при инфильтрационной анестезии МАВ 47 превосходит МАЕ-Ю. при инфипьтрационной анестезииМАВ-П превосходит тлАв-23тупо продолжительности действнгт И по ЭК 5 о.Ф ор м у л а и э о б р е т е н и и вкачестве промежуточного соединения 1(2-Этоксиэтил)3 е-метил- 4 аоксипи- в синтезе гидрохлоридов 1-(2-этоксиэ перидин формулы он тип)3 е- метил-4 ааципоксипиперидинов. Н обладающих местноанестезирующей ак ш тивностью.снсн осн НЪС 2 1 гзрХимические сдвиги (д.м.д) атомов углерода в спектрах ЯМРЮС соединения и его эпимераАктивность и длительность действия МАВ 4345.47 эталонных препаратов и МАВ-23 при терминальной и инфильтрационной анестезии пСоединение .Дпитепь - ч Показатели инильта ионной анестезии НОСЬ дбЙ Длительность действия. мин. при введении растворов Экзо. ствия в кон ента нях - соединетяв 5 1, растворе терминапьной анестезииМестоанестезируюццая активность МАВ 43.4547. эталонныхСравнительная характеристика МАВ 43,45.47 и эталонных препаратов по моделям инфипьтрационной и проводниковой анестезииъСоединение Инильта ионная анестезии Повоникорая анестезия пительность ействия ЭК 5 о д ительность ействия в мин относительно в ОТНОСИ. и при вве- 7., новокаина тельно
МПК / Метки
МПК: C07D 211/48
Метки: 1-(2-этоксиэтил)-3е-метил-4а-оксипиперидин, гидрохлоридов, активностью, 1-(2-этоксиэтил)-3е-метил-4а-ацилоксипиперидинов, синтезе, качестве, промежуточного, обладающих, соединения, местноанестизирующей
Код ссылки
<a href="https://kz.patents.su/6-3143-1-2-etoksietil-3e-metil-4a-oksipiperidin-v-kachestve-promezhutochnogo-soedineniya-v-sinteze-gidrohloridov-1-2-etoksietil-3e-metil-4a-aciloksipiperidinov-obladayushhih-mestnoanestiz.html" rel="bookmark" title="База патентов Казахстана">1-(2-Этоксиэтил)-3е-метил-4а-оксипиперидин в качестве промежуточного соединения в синтезе гидрохлоридов 1-(2-этоксиэтил)-3е-метил-4а-ацилоксипиперидинов, обладающих местноанестизирующей активностью</a>