1-(2-Этоксиэтил)-3-е-метил-4-а-этинил-4е-оксипиперидин в качестве промежуточного соединения в синтезе гидрохлоридов 1-(2-этоксиэтил)-3е-метил-4а-этинил-4е-ацилоксипиперидинов, обладающих местноанестизирующей активностью
Номер патента: 3135
Опубликовано: 15.03.1996
Авторы: Ю Валентина Константиновна, Тараков Сатыбалды Амирбекович, Алиев Абиль Эльхан-оглы, Игнатов Юрий Дмитриевич, Шин Светлана Николаевна, Пралиев Калдыбай Джайловович, Васильев Юрий Николаевич
Формула / Реферат
Изобретение касается замещенных пиперидина, в частности 1-{2-этоксиэтил)-Зе-метил-4а-этинил-4е-оксипиперидина-полупродукта для синтеза его гидрохлорида, обладающего местноанестезирующей активностью, что может быть использовано в медицине. Цель изобретения - создание нового полупродукта указанного назначения. Синтез ведут реакцией 1-(2-этоксиэтил)-3-метил-4-кетопиперидина с ацетиленом в жидком аммиаке в присутствии КОH в течении 5 ч с последующим удалением NH3 и обработкой реакционной смеси водой. На индивидуальные изомеры разделяют дробной кристаллизацией фумаратов из ацетона. Выход 77%, т.пл. 190-191°С, брутто-формула CI6H25NO6.6 табл.
Текст
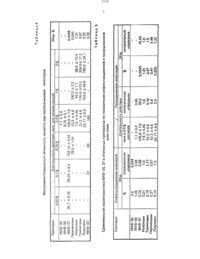
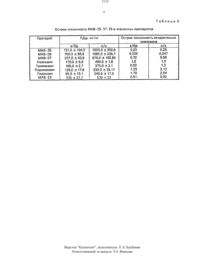
щего смесь двух стереоизомерньэх спиртов с ГП-ОАО и 0.70 (А 12 О 3. Ш степень активности,элюетат эфир). Смесь изомеров спиртов делят на индивидуальные формы дробной кристаллизацией кислых солей фумаровойткислотывиперидолов из ацетона к 6.65 гфумаровой кислоты в 400 мл кипящего ацетона добавляют 12.1 г смеси спиртов в 50 млацетона. Выпавший кристаллический оса док отфильтровывают. промывают холодным ацетоном и получают 14.4 г кислого фумарата -1-(2-этоксизтил-Эе-метитт-да-этинил-4 еоксипиперидина (7734 от смеси спиртов)с К 0.40. т.пл. 190191 С (из этанона). . . НайденодЪ С 58.87 Н 7.66 М 4.13. С 1 вН 25 МОсВычислено. С 58.70 Н 7.70 М 4.28. Киспую соль фумаровой кислоты спирта 1 переводят в основаниеобработкой раствором МаОН с последУюььтей экстракцией эфиром спирта Ъ. ИК-спектр. И смСтроение спирта 1 и его эпимера с 81 51.70. установлено на основании данных Спектры ЯМРЮС ацетиленовых спиртов с широкополосной развязкой от протонов гтолностью соответствуют предполагаемому составу (значения химических сдвигов атомов углерода приведены в таблЛ). Отнесение сигналов атомов углерода этих соединеннй проводилось по спектрам монорезонаъкса ЯМЫЗС. исходя из формы и ширины отдельныхкомгэонеъътов мультиплетов.Анализ полученных данных показывает. что стереоизомеры отличаются друг от друга ориентацией заместителей ул-Сл пиперидинового цикла. Об аксиальной ориентации этинильногт группы в соединении 1 свиде- тельствует значение химсдвига С 7 (85.1.м.д.)по сравнению со слабопольным сдвигом в его апимере (88.4 м.д.). В значениях химических сдвигов атома Св наблюдается обратная зависимость. что подтверждает приписанную ориентацию этинила. В пользу этого также говор п и ширина отдельных компонентов дублета ацетиленового углерода Ст. соединенного с Са пиперидинового цикла. Так, в спектрах монорезонанса спирта она составляет 11 Гц. а в его эпимере 7 Гцтметильная группа при Сз в обоих пиперидолах ориентирована экваториально(ширина отдельных компонентов квартета атома углерода СЪ-з группы равна Г Гц). Данные спектроскопии ПМР (400 МГц)(таблд) полностью подтверждает вышеопи спектроскопии ЯМР 1 Н и С. а также ИКС.сонную ориентацию заместителей при Сз и 4 спизртов. дек. вепичинатранс-КССВ лаза. (весе и Звала свидетельствуют об экваториальной ориентации 3 СН 3 группы в обоих изомерах при конформации кресло пиперидинового цикла. Для определения ориентации заместителей (у атома С 3 С 4 использован метод, основанный на зависимости типа Карплуса -для КССВ ЗАСН.1 указывает на аксиальную ориентацию этинильного заместителя. при которой двугранный угол между взаимодействующими ядрами равен т 18 О. В его зпимере величи на этой же КССВ составляетщв Гц. что согласуетсл с экваториальной ориентацией втинильной группы. -Экваториальная тидроксильная группа в спирте поглощает ИК-излучение при 3598 ссм 4. вто время как вего эпимере - при 3600 см 1 (ОН - аксиальная). уК раствору 7.18 г (0034 моль) спирта (в 32 мл (034 моль) уксусного ангидрида прилипают 24 мл (034 моль) хлористого ацетила. При этом наблюдается незначительное рааогревание. Смесь оставляют на 2414. Выпавший осадок отфильтровывают. промывают ацетоном и получают 8.96 г (91 4, от теоретического) гидрохлорида 1-(2-этокснэти/н-Зе-метил-да-этинил-Пе-ацетоксиптьчпе ридина (Н). т.п. 194195 С (этанол).К раствору 6.86 г (0.0325 моль) спирта о 42 мл (0325 моль) пропионового ангидрида прилипают 28 мл ( 0.325 моль хлористого пропионила. При этом наблюдается незначительное раэогревание реакционной смеси. Смесь оставляют в течение 12 ч. добавляют эфир до помутнения. Выпавший осадок отфильтровывают. промывают эфиром и получают 7.96 г (ВО.7 от теоретического гидрохлорида 1-(2-атоксиэтил)-3 е-метил-4 а-этинил-че-ктропионилоксътпиперидина (ил). т.пл. 170-172 СК раствору 9.36 г (О.0444 моль) спирта 1 в 100 мл сухого пиридина прибавляют 15.4 мл (ОДЗЗ моль) хлористого-бензоина. при этом наблюдается раэогревание смеси. После остывания смесь оставляют при комнатной температуре в течение 1211. Выпав ший осадок отфильтровывают. промывают смесью ацетон-эфир и получают 12.0 гИсследование биологической активности. Гидрохлориды 1-(2 этоксиэтил)Зеглетил-4 а-зтиттьтлще-ацетртроттионьтл, бензоил) ОКСгП 1 г 1 ер 1 дИНЭ (Н-/). синтезированные на основе соединения 1, испытаны на местног евестезьтрутотцуто активность и острую ток сичность на кафедре оэармакологии 1-го Лел-титггтэадского медитциътского института. Местноанестезьтрутощая активность ис еледоватса на моделях терьтинапьттой анестезии по методу Ренье. иттфътльтрацътотт ной аттестезиьт по методу БюльбрьтттгаУзйда.- проводниковой анестезии по глетоду Иска рева. Острая токсичность изучена на белыхбеспородных мышах обоего пола массой 165-22 г при внугрибрюшинном и подкожном введеткии.Активность и токсичность соединений НМ/срввттиваласьсаналогичньтмутпараметрами гидрохлорида 1-(2-этоксиэтил)-4-эти нил-д-бензоилоксипиттеридиъпа (МАВ-23. атталогтто структуре) и с применяемыми в медицине препаратами новокаина. тримекаина. пиромекаил-та н пидокаьтъта по показа телям длительность анестезии. мин ЭК 5 о. (эффективная концентрация) и ЛДБО. мг/кг. Суммарные данные приведены в. таблЗ-б.Соединения испытаны под индексами МАВ-Зб - соединение Н. МАВ-36 - соединение Н и МАВ-37 соединение /.При терминальной анестезии МАВ 35 и 36 не эффективны. УМАВ-З проявилась активность при введении 5 раствора. продолжительность ее действия равна 23,3 мин. в то время как МАВ-23 действует в этой концентрации 5 мин. Эталонные препаратыпри ДЗННОМ виде ЗНЗСТСЗИИ не ЭКТИВНЫ.При инфильтрационътой анестезии МАВ-35. 37 проявляют выраженное дейст-л вие при введении 1 растворов. Продолжительность анестезии равна 1235-2235 мин. В 2 растворах они действуют от 12.5 до 26,7 мин. ЭК 5 о МАВ-Зб. 37 равна 2.14 076. При данном виде анестезии МАВ-ЗБ. 37 уступают МАВ-23 И эталонным препаратам по продолжительности действия и величине ЭК 5 о. Продолжительность действия МАВ-23 в 05 растворе равна 15 мин. эталонные препараты в 1 растворах действуют от 27.5 до 36.1 мин. ЭК 5 о колеблется от 0.12При анализепроводникового действия оказалось. что исследуемые соединения проявляют выраженную анестеаиэо в 0,5 растворе. Продолжительность действия давно 7.1 (МАВгЗБ). 8.75 (МАВ-Зб) и 195(МАВ-З 7) глин. МАЕ-З обладает выраженным действием уже в 0.05 концентрации(продолжительность действия его равна 35.7 глин). Эталонные препараты проявляют подобную активность при 0.25 и большей концентрации. МАВ-23 в 0.1 растворе действуетфв течение 20 мин. По Экш мявот равен тритмекаьтт-ту, превосходит новокаин и лидокаин и уступает пиромекаитту и МАВ 2 Зхарактеристика МАВ-ЗБ. 37 и эталонных препаратов при инфильтрацьтонной и про родниковой анестезии.При сравнении остройтоксьтчллести исследуемых веществ оказалось. что МАВ-Зб и 36 аттачительтсо менее токсичны эталонных препаратов и МАВ-23 при внутрибряояиинпом и подкожном введеттиьт. ГИАЕЗ-З при внутрибртсшизтном введении более токсичен. чем МАВ 23. и менее токсичен (в 1.3-2 д.5 раза). чем эталонные препараты. при подкожном введении МАЕ-З в 1.6 раза менее токсичен. чем МАВ-23. а эталоны в 1.7-36Таким образом. синтезированные из соединения вещества проявляют местноаттостезирутоцтуто активность. При терминальной анестезии МАЕ-З по про должительности действия превышает мАв 23, эталонные препараты при данном виде анестезии не активны. При инфипьтрационной анестезии МАВ-Зб. 37 уступают МАВ-23 и эталонным препаратам. МАВ-З 7 вызывает проводнийовуто анестезию более длительную чем эталонные препараты и МАВ 23. причем в меньшей концентрации. МАВ 35. 37 менее токснчны. чем эталонные препараты, при Ънутрибркоцшнном введении. - приПОДКОЖНОМ ВВЕДЕНИИ ОНИ менеетоксичныВ качестве промежуточного СОЕДИНЕНИЯ В синтезе гидрохлоридов 1-(2-этоксиэтип)-Земетил-да-этиъил 4 еацилоксипиперидинов. обладающих местноанестезирующей активностьто.об Н фы . . хзшхоцзд юН щмч хвшмщвоаз об Н ы. Б . хзтмшза 03 Н юн завкома шк н от . Блш ы н к . . штдмга Н . 852 шгзюхошо щхзщмошс дшоошьош тхзюмото . . охасонзсохьо . охщсшнзоошьо кашпо щ хк оздцшьзоохьо ж.щзттьошхш ыютохзхчошодь . шхюоьошхш ышгхо шддсзех . . ьюашсщцс8.0 я в . ют . юыъщзг ыщо чю Н об обчН 060 . об Н фш шзтмочз дно . ч ноеоы юн то ЭЙ ч тазаь 5 ч н щшю н п юччн шк. . хзшмошо год в ты н мычи н п т н оты . шжшзоцзШК Н от . жен Зыг дюн шщюш . шЬфН Ьшт вюьш 2ззтшьошшю вошохзшчошоц а шьошцбш льоошшзьмш шшЭ 9 цтшьошшоьошЕ
МПК / Метки
МПК: C07D 211/48
Метки: качестве, местноанестизирующей, синтезе, промежуточного, 1-(2-этоксиэтил)-3-е-метил-4-а-этинил-4е-оксипиперидин, соединения, гидрохлоридов, обладающих, 1-(2-этоксиэтил)-3е-метил-4а-этинил-4е-ацилоксипиперидинов, активностью
Код ссылки
<a href="https://kz.patents.su/6-3135-1-2-etoksietil-3-e-metil-4-a-etinil-4e-oksipiperidin-v-kachestve-promezhutochnogo-soedineniya-v-sinteze-gidrohloridov-1-2-etoksietil-3e-metil-4a-etinil-4e-aciloksipiperidinov-oblad.html" rel="bookmark" title="База патентов Казахстана">1-(2-Этоксиэтил)-3-е-метил-4-а-этинил-4е-оксипиперидин в качестве промежуточного соединения в синтезе гидрохлоридов 1-(2-этоксиэтил)-3е-метил-4а-этинил-4е-ацилоксипиперидинов, обладающих местноанестизирующей активностью</a>
Предыдущий патент: Устройство для определения физических свойств жидкостей и газов
Следующий патент: Шихта для керамического пигмента
Случайный патент: Способ приготовления битумной мастики (варианты)