Способ получения генетически модифицированных растений рапса, экспрессирующих ген транскрипционного фактора atdreb1a
Номер инновационного патента: 29028
Опубликовано: 15.10.2014
Авторы: Наргилова Руфина Мустафаевна, Писаренко Алена Михайловна, Карпова Оксана Владиславовна, Искаков Булат Кудайбергенович
Формула / Реферат
Способ получения генетически модифицированных растений рапса, экспрессирующих ген транскрипционного фактора AtDREBIA, относится к области физиологии, биохимии и биотехнологии растений, молекулярной биологии и генетической инженерии.
Достигаемый технический результат - Заявленный способ позволяет получать генетически модифицированные растения рапса сортов «Нуо1а», «Крис» и «Гадемин», используя в качестве трансгенов полезные гены. Полученные в ходе разработки изобретения генетически модифицированные растения, экспрессирующие ген транскрипционного фактора AtDREBIA, могут служить модельными объектами для изучения воздействия абиотического стресса (холода и засухи) на растения, а также после ряда лабораторных и полевых испытаний могут в дальнейшем стать исходными линиями для создания казахстанских сортов рапса, устойчивых к абиотическому стрессу.
Предлагается при трансформации растений рапса другими целевыми генами, белковые продукты которых имеют хозяйственно полезные признаки, использовать разработанный способ получения трансгенного рапса.
Текст
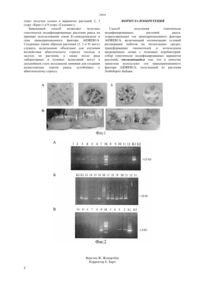
(51) 12 5/04 (2006.01) 12 15/63 (2006.01) 12 15/82 (2006.01) 12 15/90 (2006.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН, относится к области физиологии,биохимии и биотехнологии растений, молекулярной биологии и генетической инженерии. Достигаемый технический результат Заявленный способ позволяет получать генетически модифицированные растения рапса сортов Нуоа,Крис и Гадемин, используя в качестве трансгенов полезные гены. Полученные в ходе разработки изобретения генетически модифицированные растения, экспрессирующие ген транскрипционного фактора , могут служить модельными объектами для изучения воздействия абиотического стресса (холода и засухи) на растения, а также после ряда лабораторных и полевых испытаний могут в дальнейшем стать исходными линиями для создания казахстанских сортов рапса, устойчивых к абиотическому стрессу. Предлагается при трансформации растений рапса другими целевыми генами, белковые продукты которых имеют хозяйственно полезные признаки,использовать разработанный способ получения трансгенного рапса.(72) Искаков Булат Кудайбергенович Наргилова Руфина Мустафаевна Карпова Оксана Владиславовна Писаренко Алена Михайловна(73) Республиканское государственное предприятие на праве хозяйственного ведения Институт молекулярной биологии и биохимии им. М.А. Айтхожина Комитета науки Министерства образования и науки Республики Казахстан(56) Сахно Л.А., Моргун Б.В. и др. Создание трансформированных растений рапса,экспрессирующих ген сур 11 А 1 цитохрома 450 животного происхождения. Биотехнология. Украина, 2010. Т. 3, 5, с.74-82(54) СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ РАПСА,ЭКСПРЕССИРУЮЩИХ ГЕН ТРАНСКРИПЦИОННОГО ФАКТОРА 1(57) Способ получения генетически модифицированных растений рапса,экспрессирующих ген транскрипционного фактора Изобретение относится к области физиологии и биотехнологии растений, молекулярной биологии и генетической инженерии. Методы генной инженерии в сочетании с классическими методами селекции позволяют получать новые сорта сельскохозяйственных растений за короткие сроки. Известен способ трансформации отдельных тканей растений рапсас помощью бинарных агробактериальных векторов. Получены трансгенные растения, обладающие полезными свойствами, такими как изменение состава растительного масла и белка в семенах рапса, толерантность к гербицидам,устойчивость к действию насекомых и грибной инфекции, увеличение антиокислительной активности тканей листа (-//. . . . .1992.-. 89.-.2624-2628// ..-1996.-.112.-.115-120 Сахно Л.А,Моргун Б.В, и др. Создание трансформированных растений рапса, экспрессирующих генцитохрома 450 животного происхождения // Ботехнологя, Украина, у 2010. Т. 3, 56.74-82. Недостатком данного способа является тот факт,что эффективность регенерации растенийи стабильность трансформации растительных тканей являются двумя важными лимитирующими показателями в молекулярной селекции и, как правило, находятся в сильной зависимости от генотипа, а также от вида трансгена, который вводят внутрь генома растения. Кроме того, у трансгенных побегов могут быть сложности с корнеобразованием. Поэтому очень важен подбор условий для успешной трансформации, регенерации и укоренения побегов для каждого отдельно взятого сорта и отдельно взятого трансгена. Задачей данного изобретения является разработка способа получения генетически модифицированных растений рапса на примере гена транскрипционного фактора 1, полученного из. Продукт этого гена повышает устойчивость растений к таким абиотическим стрессам как холод и засуха. Поставленная задача достигается путем трансформации, включающем оптимизацию условий регенерации побегов растений рапса трех сортов Нуо 1 а, Крис и Гадемин, проведение инокуляции котиледонов и гипокотилей рапса с использованием суспензиии получение полноценных побегов, несущих в своем геноме трансгены 1 или -глюкуронидазы. Присутствие в листьях растений фрагментов рекомбинантных ДНК и соответствующих им РНКтранскриптов доказано методом полимеразной цепной реакции (ПЦР) и обратной транскрипции (ОТ-ПЦР). Пример 1. Трансформацию растений проводили методом кокультивации с агробактериями штамма 2260, содержащего бинарный плазмидный вектор 2300,который нес в своем составе кассету 35 промотор- 5- 1 -3 ТМ - терминатор гена нопалинсинтетазы или 358-промотор- 5 -3 - терминатор гена нопалинсинтетазы. Ночную культуру агробактерий выращивали на среде Лурия-Бертани, содержащей 100 мкг/л канамицина. Клетки собирали центрифугированием при 60007 мин., затем гомогенизировали в среде ММА (1 х соли Мурасиге-Скуга, 10 мМ 2-(морфолино)-этансульфоновая кислоты,20 г/л сахарозы,5,6 и 200 М ацетосирингона),выращивали в течение 1 ч при 24 С. Затем культуру разбавляли средой ММА до оптической плотности 0,85 о.е. при 600 и далее использовали для инокуляции растительных тканей. Трансформацию и последующую культивацию эксплантов проводили на двух системах сред (таблица 1) при 25 С и световом режиме 16 ч /8 ч. Таблица 1 Системы культуральных сред, использованных для каллусообразования и органогенеза в ходе регенерации гипокотилей (1) и котиледонов рапса (2)системы Состав сред для отдельных стадий органогенеза для каллусообразования среда Мурасиге-Скугас добавлением 1 мг/л 2,4 - Д для органогенезас добавлением 4 мг/л БАП, 2 мг/л зеатина для побегообразованияс добавлением 3 мг/л БАП,2 мг/л зеатина затем,с добавлением 0,05 мг/л БАП для укорененияс добавлением 5 мг/л ИБК для каллусогенеза и органогенезас добавлением 4,5 мг/л БАП для побегообразованияс добавлением 0,5 мг/л БАП для укорененияс добавлением 5 мг/л индолбутириковой кислоты (ИБК) Срок культивирования эксплантов 10-14 дней 14 дней 2 недели до образования побегов до появления корней 6-8 недель до образования побегов до появления корней Экспланты сортаинокулировали рекомбинантной ДНК, несущей ген -ген, и использовали как положительный контроль. Экспланты сортов Крис и Гадемин рекомбинантной ДНК, содержащей в своем составе ген 1. Для экспериментов брали 8-10 дневные проростки семян рапса сортов ,Крис и Гадемин. Проростки разбирали на гипокотили и котиледоны, затем помещали на среду для каллусообразования, содержащую гормоны для гипокотилей - 2, 4 -дихлорфеноксиуксусную кислоту (2,4 Д) в концентрации 1 мг/л для котиледонов - 4,5 мг/л 6-бензиламинопурина (БАП). Через 2 дня экспланты инокулировали агробактериями с добавлением ацетосирингона 200 в течение 10 минут и далее помещали на среду для каллусообразования. Для удаления агробактерий на вторые сутки после инокуляции использовали цефотаксим (500 мг/л), а для селекции трансформантов - канамицин (25-50 мг/л) после 2 недель инкубации на питательных средах. Через 2 недели гипокотили переносили на среду для побегообразования, содержащую БАП 4 мг/л и зеатин 2 мг/л, тогда как котиледоны продолжали инкубировать на среде с концентрацией БАП 4,5 мг/л. Через 6-8 недель инкубации экспланты помещали на среду с 0,5 мг/л БАП. Первые побеги были получены через 8-10 недель, первые укоренившиеся растения-регенеранты - через 3-4 месяца культивации на питательных средах(рисунок 1). Препарат ДНК из листьев растений,полученных после регенерации, выделяли методом с использованием цетил-триэтиламмониум бромида(СТАВ). Экстракционный буфер содержал 2 СТАВ, 2 , 1,4 М , 20,8,0,100-,8,0, 2 -меркаптэтанола. 1 см листьев перемалывали стеклянной палочкой в 700 мкл буфера, добавляли 2 мкл РНКазы А(10 мкг/мл), прогревали 15 мин. на водяной бане при 65 С. Затем добавляли равный объем хлороформа,встряхивали 5 мин и центрифугировали 10 мин при 14500 . Верхнюю фазу переносили в новую пробирку и добавляли 2/3 объема изопропанола,выдерживали 15 мин при комнатной температуре и снова центрифугировали. Фиг.1 - Внешний вид эксплантов после 4 недель(В),полученных после трансформации агробактериями,несущими в геноме кассету 358-промотор - 5 - 3 - -терминатор Осадок промывали 70-ным этанолом,подсушивали и переосаждали при - 20 С в 2 М растворес добавлением 2-х объемов 96-ного этанола. После центрифугирования осадок промывали 70-ным этанолом, подсушивали и растворяли в 30-50 мкл стерильной деионизированной воды. На ПЦР-анализ, который проводили с помощью -полимеразы согласно рекомендациям от фирмы , брали по 1-2 мкл препарата. Использовали праймеры смысловой вариант был подобран к 3-концу кодирующей последовательности гена 1, антисмысловой вариант к 5-концу последовательности 3- . Программа ПЦР включала 95 С 5 мин, 1 цикл 94 С 30 с, 57 С 1 мин, 72 С 1 мин, 30 циклов 72 С 5 мин, 1 цикл. В ходе ПЦР-анализа выделенных ДНК обнаружены растения, несущие в своем геноме рекомбинантные ДНК-последовательности(фиг.2 А). Эффективность трансформации трех использованных сортов и двух вариантов генов была разная. Из 26 проверенных растений сорта Нуо 1 а 21 растение (-вариант ДНК-кассеты,дорожки 13, 15-21 на рисунке 2 Б), из 12 растений сорта Крис 4 (1-вариант ДНК-кассеты,дорожки 2, 3, 5, 6). Фиг.2 - Результаты электрофореза в 1-ном агарозном геле продуктов анализа растительных ДНК (-сорта Крис и Гадемин и Б - сорт Нуо 1 а) и РНК (В) трансгенных растений,экспрессирующих трансген 1 (К 1 контроль положительный,К 2 контроль отрицательный, М-маркеры, размер одной из их полос указан справа) Из 18 растений сорта Гадемин только 2 растения(1-вариант ДНК-кассеты,дорожка 9 и 13 (не показана дали положительный ответ. Это позволяет утверждать,что эффективность трансформации у разных сортов,использованных нами, была разная. Наилучший ответ был получен нами у сорта Нуо 1 а, менее отзывчивым был сорт Гадемин. Пример 2. Для доказательства экспрессии рекомбинантного гена 1 нами были выделены отдельно препараты тотальных РНК из листьев полученных трансгенных растений 2, 3, 4, 5,6, 7, 10, 11 сорта Крис и 8, 9 сорта Гадемин. Кусочки листьев (0,5 г) гомогенизировали в жидком азоте. К порошку добавляли 10 мл тризола,оттаивали до комнатной температуры. К образцам добавляли 2 мл хлороформа,тщательно перемешивали, инкубировали 5 мин при комнатной температуре. Затем центрифугировали 15 мин при 13000 при 4 С. Верхнюю водную фазу переносили в новую пробирку и добавляли равный объем изопропанола, встряхивали и инкубировали во льду 30 мин. Затем снова центрифугировали и осадок промывали 70-ным этанолом, снова центрифугировали, подсушивали и растворяли в 30 мкл стерильной деионизированной воды. Концентрацию РНК определяли при 600. С помощью методов обратной транскрипции с участием обратной транскриптазы - и сопряженной с ней ПЦР согласно рекомендациям фирмыбыл проведен анализ тотальных РНК. Для проведения анализа брали 5 мкг РНК,реакцию ОТ проводили с участием праймера 18, сопряженную ПЦР - с участием смыслового праймера 18 и антисмыслового к 5-концу последовательности 3-. В результате было обнаружено, что не все трансгенные линии,которые дали положительный ответ на присутствие последовательности клонированного варианта гена 1,синтезируют в клетках РНК рекомбинантного типа (фиг.2 В). Положительный 3 ответ получен только в вариантах растений 2, 3(сорт Крис) и 9 (сорт Гадемин). Заявленный способ позволяет получать генетически модифицированные растения рапса на примере использования генов -глюкуронидазы и гена транскрипционного фактора 1. Созданные таким образом растения (2, 3 и 9) могут служить модельными объектами для изучения воздействия абиотического стресса (холода и засухи) на растения, а также после ряда лабораторных и полевых испытаний могут в дальнейшем стать исходными линиями для создания казахстанских сортов рапса, устойчивых к абиотическому стрессу. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения генетически модифицированных растений рапса,эспрессирующих ген транскрипционного фактора 1, включающий оптимизацию условий регенерации побегов на питательных средах,трансформацию гипокотилей и котиледонов пророщенных семян с помощью агробактерий,отбор генетически модифицированных вариантов растений, отличающийся тем, что в качестве трансгена используют ген транскрипционного фактора 1, полученный из растения.
МПК / Метки
МПК: C12N 5/04, C12N 15/63, C12N 15/90, C12N 15/82
Метки: atdreb1a, фактора, рапса, ген, экспрессирующих, получения, генетически, растений, модифицированных, способ, транскрипционного
Код ссылки
<a href="https://kz.patents.su/4-ip29028-sposob-polucheniya-geneticheski-modificirovannyh-rastenijj-rapsa-ekspressiruyushhih-gen-transkripcionnogo-faktora-atdreb1a.html" rel="bookmark" title="База патентов Казахстана">Способ получения генетически модифицированных растений рапса, экспрессирующих ген транскрипционного фактора atdreb1a</a>
Предыдущий патент: Штамм бактерий dietzia maris 84t, используемый для очистки почвы и воды от нефти и нефтепродуктов
Следующий патент: Способ охлаждения труб
Случайный патент: Способ получения метиловых эфиров 2-гетарил-3-метоксиакриловой кислоты