Способ получения производных 3-окси-2-циклогексен-1-она
Формула / Реферат
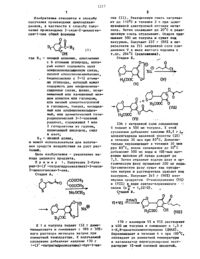
Изобретение относится к циклическим кетонам, в частности к получению производных 3-окси-2-циклогексен-1-она формулы CH2-CHR1-CH2-C(O)-C = [С(О)R2] - С(ОН), где R1 - низший алкенил. С6 - циклоалкил, который может содержать одну олефиноненасыщенную связь, низший алкилтионизший-алкил, С7-12 -бициклоалкил, который может содержать две олефиноненасыщенные связи, фенил, незамещенный или замещенный низшим алкилом или галоидом, или низшей алкилтиогруппой и галоидом, толуил, насыщенный или олефиноненасыщенный, или ароматический гетероциклический 5-7-членный радикал, содержащий 1 или 2 гетероатома из группы, включающей О, S, N; R2 - низший алкил, которые могут быть использованы для получения средств воздействия на рост растений. Цель - повышение выхода целевого продукта. Получение его ведут из соединения ф-лы где R1 указано выше, и сложного диалкилового эфира малоновой кислоты ф-лы СН2(СOOR3) , где R3 - низший алкил, в присутствии щелочного основания при температуре от комнатной до 110 С в среде ароматического растворителя, обеспечивающего отгонку в виде азеотропа выделившегося спирта. Полученное соединение подвергают взаимодействию с соединением ф-лы R2-С(О) Hаl(I), где R2 имеет указанное значение, а Наl - галоид при 40-140°С, в среде ароматического растворителя. Полученную при этом смесь сложных эфиров подвергают перегруппировке при 100 С в среде ароматического растворителя (предпочтительно после удаления избыточного соединения) в присутствии третичного амина. Полученное при этом CH(COOR3)=CHR1-CH2-С(O)-С(С(O)R2 = С(ОН), где R1, R2, R3- указаны выше, подвергают омылению и декарбоксилированию.
Текст
-Изобретение относится к способу получения пр оизводиьтх цикпоапкандиенов, в частности к способу полу чения производны 3-оксич 2 цклогек сев-1 она общей формулы- он. где К, низший апкенил, цишоалквш с 6 атонаи углерода, котог рый может содержать одну олефнноненасыщенную связь. низшей ачкилтиошаэшийапшш,бнцикпоалкил с 7-12 атомами углерода. который может содержать две олефнноиеиа сыенныесвязи фенил незамещенный или замешанный низшим алкилом или галоидон,или ниэшей-алкилтиогруппой и галондом, лчэлуип, насьщениый или олефиноненасыщениый, или ароматический гетероцнклический 5-7-члеииый Радикал, содержащий 1 или 2 гетероатоиа из группы,включающей кислород, серу И азот Ед - иизшй алкил,и может использоваться для получе.нип средств воздействия нарост рас тений.Цель изобретена увеличение выхода целевого продукта.К 1 л.толуола подают 132 г диметилиалоиата и смешивают с 180 г 302 ного раствора нетнлата натрияпри комнатной температуре, К получаемой суспензии добавляют каплям 170 г 1(тетрагидрооксатии)-бут 41-еи 2Она (11). Реакционную смесь нагревают до 110 в течение 3 ч при одновременной азеотропной отгонке метат нола. Затем охлаждают до 20 С и реакт цноиную смесь отсасывают. Осадок промввют 500 мл толуола и сушат под вакуумом. Получают 257 г (882 в перерасчете на 1) натриевой соли соединения Ч в виде желтого порошка с т.пл. 294 С (разложение). Стаднв Б.23 д г натриевой соли соединения Ч подают в 500 мл толуола. 1 С этой. суспензии.добавляют каплями 85,2 г 1 хлорангндрида масляной кислоты (1) в течение 30 мни при 85 С. Дополнительно перемешвают в течение 30 мин при В 5 С, после охлаждении до 50 С добавляют 500 мл воды и 102-ным натч ровым щелоком рН среды доводят до75. Затем отделяют водную фазу и ор ганическую фазу промают 200 мл воды. Органическую фазу сушат над супьфа том натрия и растворитель удаляют под вакуумом. Получают 2 д 5 г (902) наомернык продуктов О-ацилированя (Ч) и (Ч 11) в виде светлокорнчневого гс масла. (п - 1.5210). Чтадия В.170 г изомеров Ч 1 н Ч 11 растворяют в 400 мл толуола и сменвают с 1,5 г 4 Н,Ндиметиламинопиридина (ДМАп). Перемешивают в течение Д ч при 100 С охлаждают до комнатной температуры и катализатор перегруппировки экстрагируют 12 ной соляной кислотой.После сушки над сульфатом натрия подвануумом из органческой фазы уда лают растворитель. Получают 162 г(952 теории) продукта Ч 11 в виде светлокоричневого масла (п 1544 ОЪ Стадия Г.Е Т 36 г продукта Ч 111 растворяют в д 80 г 102 ного натрового шелока и перемелинают в течение 2 ч при 80 С. Затеи поднисляют при 60 С 108 мл концентрироааниой соляной кислоты, от сасывают осадок после охлаждения до коннатной температуры и промывают водой до нейтральной реакции. После сушин под вакуумом получают 100, г(892 теорни)2 бутирил 5(3 тетрагидрооксатинн)3 окси 2 цпклогексен 71 цез в виде светложелтых кристаллов д т.лл. 72 м 73 с.Таким образом, выход целевого продукта составляет примерно БЗ В пересчете на Ы, внеиасышенный кетон.К раствору 132 г диметилмалоната а 1 лтолуола прибавляют 180 г 302 ного раствора метилата натрия при комнатной температуре. К получаемой смеси интенсивно перемешивая, пригбавлнют по каплям 160 г лметипбена Еалацетона. геакционную смесь нагре Двают в течение 3 ч, при этом одиоврененно осуществляют азеотропную отгонку метанола, пока не будет достиг Ьнута переходная темература 11 ОС. Затеи добавляют 106 г хлорангицрида масляной кислоты при -8090 С.ндополостаткуприбанляютраствор 120 г гидро Ъокиси натрия 1, 5 л водыи в течение 2 ч ПЕРенешвают при В 0 с. Затеи подкислпшт 270 н концентрированной солл.ной кислоты при 60 С, получаемой осадок отсасывают после охлаждения до комнатной температуры Н промьшают водой до нейтральной реакции. После сушки получают 239 г (ЗВЕ), в переК раствору 132 г дииетилиалонгта в 1 л толуола добавляют 180 г 302 НОГО раствора НЕТНЛЗТЗ НЗТРНЯ. ЗЗТН добаалют по каплям при сильном перемешивании 147 г 1(пирнд 3 ил)бут 1 ен-3 она. Реакционную смесь подогреваютБ течение 3 ч, при этом одновременно осуществляют отгонку метанола, пока не будет достигнута переходная температура 11 ОС. Затем-добавляют 92,5 г хлорангидрида пропионовой кислоты при 8 Ос, в течение 1 ч дополнительно перемешивают при 80 С. После добавления 5 г д-а,одиМЕТНЛЗЪЧННОПИРИДННЗ ПЕРЕМВШНВЭЮТ В течение 4 ч при 100 С. После охлаждения до комнатной температуры реакционную смесь дважды экстрагируют 102 ным натровьоащелокоы, взятым в общем ко личестве 1,2 кг, и.получаемый щелочной экстракт затем перемешивают в течение 3 ч при 60 С. Затем к реак ционной смеси добавляют 365 г 302 ной соляной кислоты и перемешивают н течене 2 ч при 5 ОС. После охлажденнп до номнатной температуры вещавШее ТВЕВДОЕ ВЕЩЕСТВО ОТСЗСЫНЗЮТ,ПРОМЫВЗЮТ ВОДОЙ И сушат. ТОЛТ-ЭЮТ 189 г (772), В пересчете на Ы, Бнеиасьшенный кетон, 2 пропионил(5 пнрнд-3 ил)3 онси 2 циклогексен 1 она с т.лл. 80-81 С. .Аналогично примеру 1 подвергают взаимодействию раствор 132 г диметилналоната в 1 л толуола, 180 г 302 ного нетилата натрия, 152 г 1-цикло 1 генсилБут 1 ен 3-она-и 1 О 6,5.г хлорангидрида масляной ниспоты. К получаемой реакционной смеси добавляют 5 г ыВдиметиламинопириднна дополнительно перемешвают в теченне4 ч при 100 С н затем охлаждают до комнатной температуры Затем дважды экстрагируют гидроокисью натрия, венев 1,5 л воды, н объединенные щелочные экстракты перемешивают в течение 2 чпри 80 С. Затем подкисляют 270 мл Ьоицентрированной соляной кислоты при 50 С экстрагируют получаемое масло хлористым метиловом, экстракты проывают водой и сгущают в вакууме. Получают 222 г (8 д 2) в пересчете на К, Вненасыщенный кетон,2 бутирил 5 цклогексил 3 окси 2 ннкпогексен 1-она в виде светло-корнчневого масла (п 15 д 26).К раствору 232 г диметилмалоната в 1 л кислоты прибавляют 180 г 302 ного раствора метнлата натрия при комнатной температуре. К получаемой смеси, интенсивно перемешвая, прибавляют по каплям 160 г пэтилбензалацетона. Реакционную смесь нагревают в течене 3 ч, при этом одновременно осуществляют азеотропную отгонку метанола, пока не будет достигнута переходная температура ттос. Затем добавляют три эквивалента хлорангидрнда масляной кислоты при 80 С,дополнительно перемешивают в течение 15 мин, после чего избыток отгоняют. После добавления 5 г дтЫ,Ыдиметнламхаиопнрнднна в течение 3-4 ч перемешвают при 100 С н затем упаривают растворитель. К получаемому остатку прибавляют раствор 120 г гидроокиси натрия в 1,5 л воды и в течение 2 ч перемешивают при 80 С. Затем подкиспяют 270 мл концентрированной соляной кислоты при 60 С, получаемый осадок отсасывают после охлаждения до комнатной темературы и промывают водой до нейтральнойреакщи. После сушки получают 2 бутирнл 5(пэтнл феннл)3 окси 2 циклогексен 1 он с т.пп. 72-739 С. Выход 652 в пересчете на Ы, Нненасыщенный кетон.К раствору 132 г днметилмалоната в 1 п растворителя прибавляют 180 г 301 иого раствора метилата натрия при температуре А. К получаемой сме. Цси, интенсивно переменная, прибавляют по каплям 160 г п-этилбсн 3 ала.цетона. Реакционную смесь нагревают в течение времени Б, при этом ед 6новременно осуществляют азеотропную отгонку метанола в пределах температуры В. Затем добавляют 106 г хлорангндрида масляной кислоты при темературе Г н дополнительно перемешивают. После добавления 5 г дК,Ыдиме типаминопириднна в течение 3-й ч перемешивают при 100 С н затем упарнвают растворитель. Кполучаемому остатку прибавляют раствор 120 г гидроокиси натрия в 1,5 л воды н в течение 2 ч перемешивают при Е 0 С. 3 атем 4 подннсляют 270 мл концентрированной соляной кислоты при 60 С получаемый осадок отсасывают после охлаждения до комнатной температуры и промывают водой до нейтральной реаяцни.После сушкиполучают 2 Бутирил 5-(п-этилфеннл)-3-окси 2 цинлогекен 1 он с т.пл,72-7396, Данные приведены в табл. 1.Аналогично примерам 1-6 получают соединения формулы (1), приведенные в табл. 2 и 3.П р н м ер 32. Ссравнительны). 170 г 1(3 тетрагидротиопиранил) бут-1-ен-3-она добавляют к 132 г диметилмалоната при комнатной теноратуре н смешивают с 180 г 30 Еного метанольного раствора метнлата натрия. переманивают в течение 4 ч при 60 С и реакционную смесь смешивают с 600 г 102 ного натрового щелока после чего дополнительно перемепмвают в течение 3 ч при 110 С при одновременной отгонке метанола. Затем реакцонную смесь смешивают с 200 мл толуола ъгводнуюфаау отделяют. водную фазу подкисляют концентрированной соляной кислотой при б 0 С и после охлаждения до комнатной температурывыпавший осадок отсасывают и промывают водой до нейтральной реакции. После сушки под вакуумом при 60 С получают 187 г 5(3 тетрагидротнопиранил 3-3-оксицинлогекс 2-еитона (Б) в вице желтоваты крнсталловкс т.пл. 166168 С. Вышод 88 в пересчете на исходный кетон.187 г 5-(3 тетрагпдротиопиранил)3-оксицмклогекс 2 ен 1-онарастворяют в 500 мл толуола и при 85 С смешивают с 940 г хлорангидрида Масляной кислоты. Затем дополнительно перемешвают в течение 2 ч при 85 С Ь после охлаждения до 50 С добавляют 500 мл воды. Водиую фазу отделяют, а органическую фазу экстрагируютдП 0 н 02 ного натрового щспока. Щелочной экстракт подкисляют концентрированной соляной кислотой, осадок отсасывают, промывают водой до нейтральной реакции и сушат под вакуумом при 50 С. Получат 150,6 г (6123 в пересчете на нсходнй циклогексанон 2-бутирил-5-(3 тетрагидротиопн ранл)3 окси 2 циклогексен 1 она в виде коричневых кристаллов сАналогично получают соединения примеров 2-5. 71 д, 17-19, 22 и 2 д 31 с выходом, указанны в табл. д(в скобках приведен вьшод в соответствующем примере).дпоэволяет увеличить вышод целевого1. Способ получения производным З-окси 2 цикпогексен 1 она общей фор циклыгдд нт нашмй алненнл, цклоалкип с 6 атомами углерода, который может содержать одну опефнионенасыенную связь,низший алкнлтионизшийшхкил,бнцитотоалкил с 7-12 атомами углерода, который может содержать две олефиноненасы шеннййсннзн, фенил, незамещенныя или замощенный низшин алкнлон или галоипои или низшей алкиптиогруппой и гапондом, толунп, насыщенный или олефиионенасышенны, н, Ь или ароматический гетероцик лическнй 5-7-членный радикал, -содержапнн 1 или 2 геч тероатома из группы, включающей кислород, серу и азот 31 низший алкил,путем взаимодействия соединения обцен формулыгде К, имеет указанное значение,со сложным дналкиловым эфиром малоновой кислоты общей формулыв среде растворителя с последующей переработкой получаемого при этомсоединения с применением омпеиия,декарбоксилировання и ацлированя соединением общей формулыс последующн выделением целевого продукта, о т л н ч аю Щ н й с я тем, что, с целью повыения выхода целевого продукта, реакцию соединений 11 и 111 проводят при темера туре от комнатной до 10 С в среде ароматического растворителя, позволяющего отгонку в виде азеотропа выделившегося спирта, получаемое при этом соединение общей формулыгде В, и В имеют указанные значения, Не -щелочной металл, подвергают взаимодействию с соединением общей формулы 1 при 40-1 д 0 С,получаемую при этом смесь сложны эфиров общин формулгде к, Ктди Ед имеют указанные знаеченнн, подвергают перегруппировка прн1 О 0 С в присутствии третичного ан на и получаемое при этом соединено
МПК / Метки
МПК: C07C 49/713
Метки: получения, производных, 3-окси-2-циклогексен-1-она, способ
Код ссылки
<a href="https://kz.patents.su/9-1217-sposob-polucheniya-proizvodnyh-3-oksi-2-ciklogeksen-1-ona.html" rel="bookmark" title="База патентов Казахстана">Способ получения производных 3-окси-2-циклогексен-1-она</a>
Предыдущий патент: Способ получения метакролеина или акролеина
Следующий патент: Способ получения терефталевой кислоты
Случайный патент: Способ получения иммуноглобулина диагностического сибиреязвенного флуоресцирующего