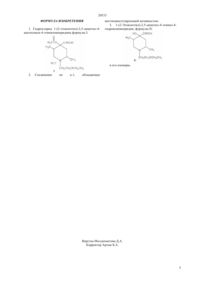
Гидрохлорид 1-(2-этоксиэтил)-2,5-диметил-4-ацетилокси-4-этинилпиперидина, обладающий местноанестезирующей активностью и полупродукт его синтеза
Формула / Реферат
Изобретение относится к гидрохлориду 1-(2-этоксиэтил)-2,5 -диметил-4-ацетилокси-4-этинилпи-перидина формулы I, обладающему местноанесте-зирующим действием, а также к полупродукту его синтеза - 1-(2-этоксиэтил)-2,5-диметил-4-этинил-4-гидроксипиперидину, формулы II.
Соединение формулы II предложено получать этинилированием 1-(2-этоксиэтил)-2,5-диметил-4-оксопиперидина (III), и разделением колоночной хроматографией на индивидуальные стереоизо-мерные формы. Последующее ацилирование 1-(2-этоксиэтил)-2,5-диметил-4-этинил-4-гидроксипипе-ридина приводит к гидрохлориду 1-(2-этоксиэтил)-2,5-диметил-4-ацетилокси-4-этинилпиперидина фор-мулы I.
Текст
(51) 07 211/14 (2006.01) 07 211/18 (2006.01) 07 211/44 (2006.01) 07211/48 (2006.01) 61 31/445 (2006.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ИННОВАЦИОННОМУ ПАТЕНТУ РИДИНА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩЕЙ АКТИВНОСТЬЮ И ПОЛУПРОДУКТ ЕГО СИНТЕЗА(57) Изобретение относится к гидрохлориду 1-(2 этоксиэтил)-2,5 -диметил-4-ацетилокси-4-этинилпиперидина формулы , обладающему местноанестезирующим действием, а также к полупродукту его синтеза - 1-(2-этоксиэтил)-2,5-диметил-4-этинил-4 гидроксипиперидину, формулы . Соединение формулыпредложено получать этинилированием 1-(2-этоксиэтил)-2,5-диметил-4 оксопиперидина , и разделением колоночной хроматографией на индивидуальные стереоизомерные формы. Последующее ацилирование 1-(2 этоксиэтил)-2,5-диметил-4-этинил-4-гидроксипиперидина приводит к гидрохлориду 1-(2-этоксиэтил)2,5-диметил-4-ацетилокси-4-этинилпиперидина формулы .(72) Пралиев Калдыбай Джайловович Искакова Тыныштык Кадыровна Абдильданова Асель Абаевна Пичхадзе Гурам Михайлович Кадырова Диляра Молдашевна Насырова Светлана Рысбековна Имашова Шырын Отановна Амиркулова Маржан Куляшовна Мухамеджанова Гулмира Советбековна(73) Дочернее государственное предприятие на праве хозяйственного ведения Институт химических наук им. А.Б. Бектурова республиканского государственного предприятия на праве хозяйственного ведения Центр наук о земле, металлургии и обогащения Комитета науки Министерства образования и науки Республики Казахстан(54) ГИДРОХЛОРИД 1-(2-ЭТОКСИЭТИЛ)-2,5 ДИМЕТИЛ-4-АЦЕТИЛОКСИ-4-ЭТИНИЛПИПЕ 20533 Изобретение относится к области фармакологически активных веществ и полупродукту их получения, конкретно к гидрохлориду 1-(2-этоксиэтил)-2,5-диметил-4 ацетилокси-4-этинилпиперидина, формулы и его изомерам, а также к промежуточному соединению его синтеза -1-(2-этоксиэтил)-2,5-диметил-4-этинил-4-гидроксипиперидину, формулы и его изомерам. Наиболее близкими известными структурными аналогами описываемых соединенийиявляется гидрохлорид 1-(2-этоксиэтил)-4-этинил-4-бензоилоксипиперидина (казкаин) формулы , обладающий антиаритмической и местноанестезирующей активностью, и полупродукт его получения - 1-(2-этоксиэтил)-4-этинил-4-гидроксипиперидин формулы Босяков Ю.Г., Утепбергенова Р.К., Шин С.Н.,Кадырова Д.М. опубл. 27.06.88/. Из используемых в настоящее время в качестве местноанестезирующих средств наиболее близким по применению к заявляемому соединениюявляется лидокаин - гидрохлорид -диэтиламино-2,6 диметилацетанилида /Машковский М.Д. Лекарственные средства. М., 1988, часть 1, с. 329-330/,новокаин гидрохлорид на парааминобензойной кислоты -диэтиламиноэтилового эфира /Машковский М.Д. Лекарственные средства. М., 1988, часть 1,с.326-328/, тримекаин - гидрохлорид -диэтиламино 2,4,6-триметилацетанилида /Машковский М.Д. Лекарственные средства. М., 1988, часть 1, с. 330-331/. Недостатком применяемых препаратов является их низкая активность. Задачей изобретения является синтез нового производного 1-(2-этоксиэтил)-2,5-диметил-4 оксопиперидина, обладающего фармакологической активностью, и полупродуктов его получения. Технический результат изобретения - уменьшение токсичности, увеличение активности и расширение спектра биологического действия. Технический результат достигается новым соединением, описываемым формулой Фармакологическая активность соединенияпредполагает использование его в медицине в качестве местноанестезирующего средства. Синтез соединенияосуществляют по следующей схеме получают ацилированием 1-(2-этоксиэтил)-2,5-диметил-4 этинил-4-гидроксипиперидинадействием смеси уксусного ангидрида и хлористого ацетила. При отгонке избытка реагентов, получают соединениев виде кристаллов с т.пл. 180 С, растворимые в воде,этаноле. 1-(2-Этоксиэтил)-2,5-диметил-4-этинил-4 гидроксипиперидина получают взаимодействием 1-(2-этоксиэтил)-2,5-диметил-4 оксопиперидинас ацетиленом в растворе жидкого аммиака в присутствии порошкообразного КОН. Соединениепредставляет собой масло,растворимое в метаноле, этаноле, этилацетате,хлороформе. Индивидуальность и строение заявляемых соединений(-) подтверждены данными элементного анализа, тонкослойной хроматографии и спектроскопии ЯМР 13 С. Пример 1. Гидрохлорид 1-(2-этоксиэтил)-2,5 диметил-4-ацетилокси-4-этинилпиперидина . К 1 г (0,0044 моль) 1-(2-этоксиэтил)-2,5-диметил 4-гидрокси-4 е-этинилпиперидинадобавляют 3,45 г (0,04 моль) хлористого ацетила и 4,48 г (0,04 моль) уксусного ангидрида. При этом наблюдается незначительное разогревание смеси, которую выдерживают 24 часа при комнатной температуре. Избыток хлористого ацетила и уксусного ангидрида удаляют в, вакууме водоструйного насоса, остаток промывают гексаном и получают 0,86 г (73 от теоретического) гидрохлорида 1-(2-этоксиэтил)-2,5 диметил-4-ацетилокси-4 е-этинилпиперидинас т.пл. 180 С. Найдено,С 59,30 Н 8,624,60 С 1 11,67. С 15 Н 263 С. Вычислено,С 59,23 Н 8,604,57 С 11,65. Спектр ЯМР 13 С (м.д.) 14,22, 55,24, 63,33, 66,92(С 2 Н 4 ОС 2 Н 5) 16,60 СН 3 (2) 11,65 СН 3(5) 58,75 (С 2) 44,82 (СЗ) 68,99 (С 4) 39,17 (С 5) 52,30 (С 6) 49,00 СН 3 (ацетата) 80,53 (С 11) 77,89 (С 12) 168,89 СО. ИК спектр см-1 СО 1745. Пример 2. 1-(2-этоксиэтил)-2,5-диметил-4 гидрокси-4-этинилпиперидин . В 3-х горлую колбу, снабженную механической мешалкой, капельной воронкой и обратным холодильником с хлоркальциевой трубкой помещают 600 мл жидкого аммиака, вносят 24 г(0,085 моль) 1-(2-этоксиэтил)-2,5 диметилпиперидин-4-она , растворенного в 50 мл серного эфира, в токе ацетилена. Общая продолжительность опыта 7 ч. После окончания реакции колбу оставляют на ночь открытой для улетучивания аммиака. Реакционную смесь разлагают 100 мл дистиллированной воды,экстрагируют бензолом, сушат над 4,растворитель упаривают, получают 15,37 г (80 от теоретического) 1-(2-этоксиэтил)-2,5-диметил-4 гидрокси-4-этинилпиперидина , в виде смеси двух стереоизомерных спиртов (0,52, 0,20). Разделение смеси изомеров. В колонку с диаметром 1,5 см помещают 0,8 кг окиси алюминия, 10 г 1-(2-этоксиэтил)-2,5-диметил-4-гидрокси-4 этинилпиперидинав виде смеси изомеров ( 0,52, и 0,20), элюируют системой растворителей гексанэфир (12). Отбирают фракции по 5-10 мл,получают 5,52 г 1-(2-этоксиэтил)-2,5-диметил-4 егидрокси-4-этинилпиперидина с т.пл.135 С (55,2 от общего количества смеси изомеров) и 2,97 г 1-(2 этоксиэтил)-2,5-диметил-4(3-гидрокси-4 е-этинилпиперидина в виде масла (29,7 от общего количества смеси изомеров). Найдено,С 69,32 Н 10,216,20. 13232. Вычислено,С 69,33 Н 10,226,22. Спектр ЯМР 13 С (м.д.) 1-(2-этоксиэтил)-2,5-диметил-4 е-гидрокси-4-этинилпиперидина 14,19, 58,77,63,33, 66,92 (С 2 Н 4 ОС 2 Н 5) 16,59 СН 3 (2), 11,64 СН 3 под лабораторным шифром МАВ-130 изучен на местноанестезирующую активность и острую токсичность. Данные сопоставлялись с показателями лидокаина, новокаина и тримекаина. Результаты исследования представлены в таблицах 1-3. Острая токсичность исследована при однократном подкожном введении соединения и эталонных препаратов белым беспородным мышам обоего пола, массой 17-23 г. Результаты опытов по изучению острой токсичности показали, что МАВ 130 оказался менее токсичным, чем препараты сравнения (табл. 1). Таблица 1. Острая токсичность МАВ-130, новокаина,лидокаина и тримекаина при внутрибрюшинном введении мышам Препарат ЛД 50, мг/кг МАВ-130 585,017,4 Новокаин 480,09,8 Лидокаин 248,618,4 Тримекаин 378,219,4 Инфильтрационная анестезирующая активность изучалась методом Бюльбринг-Уэйда на морских свинках-самцах массой 200-250 г. В область спины каждого животного, предварительно удалив с него волосяной покров, в 4 точках (по углам квадрата со стороной 3 см) внутрикожно вводили в объеме 0,2 мл изотонические растворы изучаемого соединения и эталонных препаратов. Местноанестезирующая активность оценивалась 6-8 раз для каждой из выбранных концентраций. Чувствительность в месте введения определялась прикосновением притуплнной инъекционной иглой, сериями по 6 прикосновений, через каждые 5 минут, в течение 30 минут. Определялась глубина анестезии,выраженная в индексах анестезии (среднее из 6 опытов, максимальный индекс - 36), длительность 3 20533 полной анестезии и общая продолжительность анестезирующего эффекта. Активность соединений сравнивалась с эталонными препаратами - с тримекаином, лидокаином и новокаином в соответствующих концентрациях. Результаты исследований обработаны статистически. Все соединения испытывались в 0,5 растворах. Как видно из результатов таблицы 2, соединение МАВ-130 оказало довольно выраженный эффект. В указанной концентрации индекс анестезии МАВ-130 был равен 34,30,5, а по силе анестезии в 1,3 раза превышал новокаин и был равен лидокаину и тримекаину. Полная анестезия, вызванная МАВ-130 выше, чем у препаратов сравнения, особенно четко эти различия выявлены в сравнении с новокаином. Таблица 2. Анестезирующая активность МАВ-130 при инфильтрационной анестезии по методу Бюльбринг и Уйэду Соединение,препарат МАВ-130 Новокаин Лидокаин Тримекаин Модель проводниковой анестезии. Модифицированный метод отдергивания хвоста крыс. Методбыл разработан на кафедре фармакологии Санкт-Петербургского медицинского университета имени академика И.П. Павлова. Он позволяет определить скорость наступления анестезии, ее глубину, продолжительность полной анестезии и общую продолжительность анестезирующего действия препарата. Активность соединений и препаратов сравнения изучалась в 0,25 растворах. Исследование проводилось на беспородных белых крысах-самцах,массой 200-250 г. Принцип метода заключался в регистрации латентного периода отдергивания хвоста при термическом воздействии на его среднюю часть сфокусированным пучком света от оптоэлектронного анальгезиметра ТФ-003 до и после анестезии. Интенсивность термического ноцицептивного воздействия была отрегулирована таким образом,чтобы исходные реакции отдергивания хвоста возникали с латентным периодом в интервале 3-6 секунд. Для изучения проводниковой анестезии раствор соединения или препарата в объеме 0,5 мл вводился под кожу хвоста в область нанесения термического Общая длительность анестезии (мин), (М) 551,8 30,01,3 32,51,7 50,01,8 воздействия. Животным контрольной группы вводили тем же способом и в том же объеме физиологический раствор. Первое тестирование проводилось через 5 минут после инъекции,последующие - через каждые 10 минут до полного восстановления пороговых величин. За полную анестезию принималось удлинение латентного периода в два раза. МАВ-130 и эталонные препараты (новокаин,лидокаин, тримекаин) сравнивались по временам наступления анестезии, длительности полной анестезии и общей продолжительности анестезирующего действия препарата. При проводниковой анестезии активность МАВ 130 и препаратов сравнения изучалась в 1 растворах (результаты опытов указаны в таблице 3). В указанной концентрации МАВ -30 проявил выраженную активность, особенно по длительности полной анестезии и превышал по этому параметру новокаин в 1,8 раза, тримекаин в 1,3 раза, и незначительно превышал лидокаин. Раствор МАВ 130 по общей продолжительности местноанестезирующего действия также превосходил новокаин и тримекаин (примерно в 1,8 раза) и несколько превышал эффект лидокаина. Таблица 3 Показатели проводниковой анестезии на модели отдергивания хвоста Соединение,препарат МАВ-130 Тримекаин Лидокаин Новокаин 1 раствор Длительность полной анестезии (мин) Общая продолжительность действия (мин) Описанное вещество синтезируется на основе доступного химического сырья, и оно перспективно с точки зрения создания на его основе лекарственных препаратов. Выпуск препаратов 4 может быть осуществлен на типовом промышленном оборудовании, имеющемся на предприятиях фармацевтической промышленности.
МПК / Метки
МПК: C07D 211/44, A61K 31/445, C07D 211/18, C07D 211/14
Метки: гидрохлорид, 1-(2-этоксиэтил)-2,5-диметил-4-ацетилокси-4-этинилпиперидина, синтеза, активностью, местноанестезирующей, полупродукт, обладающий
Код ссылки
<a href="https://kz.patents.su/5-ip20533-gidrohlorid-1-2-etoksietil-25-dimetil-4-acetiloksi-4-etinilpiperidina-obladayushhijj-mestnoanesteziruyushhejj-aktivnostyu-i-poluprodukt-ego-sinteza.html" rel="bookmark" title="База патентов Казахстана">Гидрохлорид 1-(2-этоксиэтил)-2,5-диметил-4-ацетилокси-4-этинилпиперидина, обладающий местноанестезирующей активностью и полупродукт его синтеза</a>
Предыдущий патент: 1-(2-этоксиэтил)-2,5-диметил-4-бензоилокси-4-(2-фенилэтил)пиперидин и его комплекс с бета-циклодекстрином и промежуточное соединение
Следующий патент: Способ получения изоникотиновой кислоты
Случайный патент: Система подачи табака в пневмотранспортную установку