Рекомбинантный штамм вируса гриппа ТB-FLU Esat6 2A Ag85A. и его использование для профилактики туберкулеза
Номер инновационного патента: 28077
Опубликовано: 15.01.2014
Авторы: Киселев Олег Иванович, Сансызбай Абылай Рысбайұлы, Стукова Марина Анатольевна, Егоров Андрей Юрьевич, Султанкулова Куляйсан Турлыбаевна, Сандыбаев Нурлан Тамамбаевич, Хайруллин Берик Мухитович
Текст
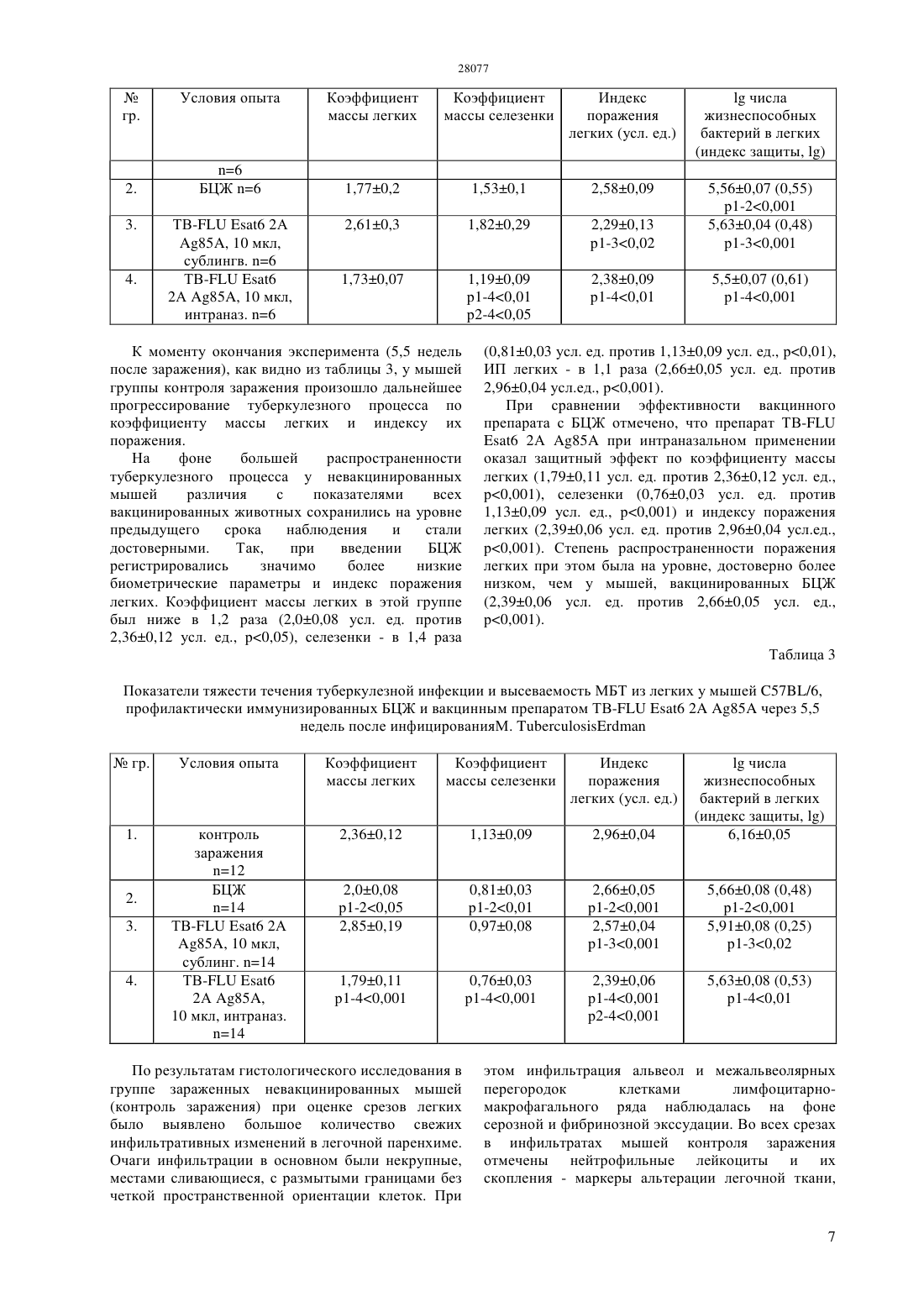
(51) 12 7/00 (2006.01) 61 39/145 (2006.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ИННОВАЦИОННОМУ ПАТЕНТУ туберкулеза легких. Нами получен живой аттенуированный рекомбинантный штамм вируса гриппа А (гриппозный вектор), стабильно экспрессирующий микобактериальные протективные антигены -6 и 85. Экспериментальные данные свидетельствуют о значительном профилактическом эффекте применения вакцинногоштамма ТВ- 6 2 А 85 в защите от экспериментального туберкулеза. Рекомбинантный штамм вируса гриппа ТВ- 6 2 А 85 при интраназальном или сублингвальном путях введения проявил протективные свойства, по ряду показателей превышающие эффект стандартной вакцины БЦЖ. В отличие от вакцины БЦЖ, предназначенной,прежде всего, для парентерального введения,рекомбинантная гриппозная вакцина может применяться интраназально или сублингвально, чем достигается активация мукозального иммунитета,что может явиться дополнительным барьером при аэрогенном заражении туберкулезом.(72) Сансызбай Абылай Рысбай лыСандыбаев Нурлан ТамамбаевичХайруллин Берик МухитовичСултанкулова Куляйсан ТурлыбаевнаКиселев Олег ИвановичЕгоров Андрей ЮрьевичСтукова Марина Анатольевна(73) Республиканское государственное предприятие на праве хозяйственного ведения Научноисследовательский институт проблем биологической безопасности Комитета науки Министерства образования и науки Республики Казахстан(54) РЕКОМБИНАНТНЫЙ ШТАММ ВИРУСА ГРИППА Т 6 2 85,ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОФИЛАКТИКИ ТУБЕРКУЛЕЗА(57) Изобретение относится к области медицины и может быть использовано для профилактики Изобретение относится к области медицины,конкретно, к созданию противотуберкулезных вакцин нового поколения. Оно может быть использовано для профилактики туберкулеза легких. С использованием последних достижений молекулярной биологии и генной инженерии сконструирован модифицированный погену рекомбинантный штамм вируса гриппа ТВ- 6 2 А 85, экспрессирующие микобактериальные антигены, на основе технологии обратной генетики. Задачей изобретения является разработка рекомбинантного вакцинного штамма ТВ- 6 2 85 на основе вируса гриппа А подтипа Н 5,экспрессирующего секреторные белки микобактерии ранний секреторный антиген -6(отсутствует в вакцинном штамме . БЦЖ) и секреторный белок 85 (присутствует в вакцинном штамме . БЦЖ), способного эффективно формировать протективный иммунный ответ у млекопитающих при интраназальном или сублингвальном введении. Поставленная задача решена с помощью методов обратной генетики, а именно, созданием живых рекомбинантных штаммов вируса гриппа 6 2 А 85(гриппозных векторов),содержащих вставку чужеродной генетической последовательности в гене 1 вируса гриппа,экспрессирующих протективные антигены. Новым является то, что присутствует секреторный белок 85(присутствует в вакцинном штамме . БЦЖ). Микобактерий туберкулеза являются серьезной глобальной угрозой для здоровья человека. Единственной туберкулезной (ТБ) вакциной в настоящее время является бацилла КальметтаГерена (БЦЖ). Принципиальным недостатком вакцины БЦЖ является постепенное снижение напряженности поствакцинального иммунитета, что, по результатам контролируемых исследований,приводит к практически полному отсутствию защитного эффекта уже через 10 лет после вакцинации. В связи с этим в последние годы появился целый ряд работ по разработке рекомбинантных штаммов различных микроорганизмов, экспрессирующие микобактериальные протективные антигены. Рекомбинантный штамм вируса гриппа ТВ 6 2 А 85 при интраназальном или сублингвальном путях введения проявил протективные свойства, по ряду показателей превышающие эффект стандартной вакцины БЦЖ и рекомбинантного штамма с -6 В отличие от вакцины БЦЖ, предназначенной,прежде всего, для парентерального введения,рекомбинантная гриппозная вакцина может применяться интраназально или сублингвально, чем достигается активация мукозального иммунитета,что может явиться дополнительным барьером при аэрогенном заражении туберкулезом. Альтернативным подходом,позволяющим повысить иммуногенность протективных белков микобактерий без применения адъювантов, является использование аттенуированных вирусов или бактерий в качестве векторов для доставки и экспрессии антигена(ов) в организме. Известны работы по созданию рекомбинантных штаммов для профилактики туберкулеза. В настоящее время активно исследуется вакцинный потенциал векторов на основе аттенуированных вирусов - модифицированный вирус осповакцины, штамм Анкара 85,несущий протективные антигены возбудителя туберкулеза ( .и др.85.. 2007 2(10) 1052). Разработаны репликативно-дефектные аденовирусы серотипа 5 (85) и серотипа 35 (35), несущих протективные антигены возбудителя туберкулеза. Основным условием применения живых векторных вакцин у людей является надежная аттенуация вакцинного штамма и его безопасность ( М,, ,,.-.. 2006 74(8)4634-43). Наиболее близким к заявляемому является патент 2318 872, 12 7/01, опубл. 10.03.2008 г. (Рекомбинантные штаммы вируса гриппа,экспрессирующие микобактериальный протективный антиген -6, и их использование для профилактики и лечения туберкулеза). В патенте описаны живые аттенуированные рекомбинантные штаммы вируса гриппа(11), содержащие протективный антиген-6 Указанные рекомбинантные штаммы вируса гриппа(11) содержат вставку нуклеотидной последовательности-6 . между позициями 400-401 в открытой рамке считывания 1 гена. Данный патент обеспечивает терапевтический и профилактический эффект иммунизации организма на течение туберкулезного процесса. Несмотря на профилактическую и терапевтическую эффективность векторов с туберкулезным антигеном,показанную на животных моделях (Патент 2318872, С 12 7/01, опубл. 10.03.2008 г.), при их длительном культивировании на клетках , наблюдались проявления генетической нестабильности конструкции. Это выражалось в появлении дополнительных укороченных фрагментовпри проведении ПЦР анализа,содержащих разнообразные делеции вставки -6 и прилегающих участков последовательности 1 после 5 последовательных пассажей вирусов. В отличие от патента 2318872 в заявляемом рекомбинантном штамме использована продолжительная вставка микобактериальных антигенов- 6 и 85. Высокая генетическая стабильность заявляемого рекомбинантного штамма вируса гриппа ТВ 6 2 А 85 позволит производить его в качестве противотуберкулезной вакцины на перевиваемой клеточной культуре. Рекомбинантный штамм вируса гриппа ТВ 6 2 А 85 при интраназальном и сублингвальном путях введения проявил высокие протективные свойства. Цель изобретения конструирование генетически стабильного вакцинного штамма ТВ 6 2 А 85 на основе вируса гриппа А подтипа Н 5, экспрессирующего секреторные белки микобактерии ранний секреторный антиген -6(отсутствует в вакцинном штамме . БЦЖ) и секреторный белок 85 (присутствует в вакцинном штамме . БЦЖ), способного эффективно формировать протективный иммунный ответ у млекопитающих при интраназальном или сублингвальном введении. Предлагаемое изобретение включает рекомбинантный штамм,совокупность существенных признаков которого, обеспечивает получение следующих технических результатов. Техническим результатом предлагаемого изобретения является конструирование рекомбинантного штамма вируса гриппа 6 2 А 85, предназначенный для профилактики туберкулеза Сущность изобретения заключается в том, что новое поколение гриппозныхвекторов, имеют следующие конструктивные отличия от их ранних прототипов (1) наличие более короткой терминальной области натуральной последовательности 1 белка(106 аминокислотных остатков вместо 124) (2) наличие 10 случайных аминокислотных остатков в позиции 107-116 (3) наличие сигнального пептида иммуноглобулина, обеспечивающего секрецию белка-вставки во внешнюю среду зараженной клетки (4) вектор ТВ- 6 2 85 экспрессирует -6 белок в сшивке с 1 белком(фьюжен белок), а белок 85 отщепляется при помощи сайта протеолитического расщепления 2 А и секретируется наружу клетки (5) наличие нетранслируемой области после стоп кодона вставки, имеющую происхождение плазмидного поли-линкерного сайта. Описание сущности изобретения Обычная длина 1 белка у вируса гриппа//8/34 (11) составляет 230 аминокислотных остатков. Используя феномен пластичности 1 белка, ранее нами были сконструированы гриппозные векторы, имеющие вставку посторонней последовательности ( -6, ) в положении после 125 аминокислотного остатка 1 белка. В этих конструкциях вставка заканчивалась двойным стоп кодоном, после которого оставалась нетранслируемая остаточная часть 1 белка,содержащая сигналы для сплайсингам РНК 324(1)67-73(.), 2006 86(3-4)236246. Рекомбинантные вирусы были получены на основе реассортантов вируса гриппа А подтипов 11, 22, 32, адаптированных к росту в культуре клеток . Способность вирусных векторов размножаться в респираторном тракте мышей определялась природой и длиной вставки. Так вирусы, экспрессирующие белокили белокотличались гипер-аттенуированным фенотипом и были не способны к репликации в легких мышей. Напротив, вирусные векторы 1-1256,имеющие вставку белка -6 М. , в указанной позиции, хотя и не обладали летальной активностью, достигали титров 2-4 ТИД 50/г в тканях легких мышей. Несмотря на профилактическую и терапевтическую эффективность векторов с туберкулезным антигеном, показанную на животных моделях(Патент РФ 2318872, 12 7/01, опубл. 10.03.2008 г.), при их длительном культивировании на клетках , наблюдались проявления генетической нестабильности конструкции. Это выражалось в появлении дополнительных укороченных фрагментовпри проведении ПЦР анализа, содержащих разнообразные делеции вставки -6 и прилегающих участков последовательности 1(неопубликованные результаты) после 5 последовательных пассажей вирусов. Тем не менее, следует отметить, что стабильность векторов -6 была существенно выше по сравнению с вирусом, экспрессирующим,который полностью лишался функциональности вставки после 5 пассажей на клетках(по данным флюоресценции). Поскольку векторы, имеющие вставку в аминокислотной позиции 125 белка, 1 не были достаточно стабильны при пассировании, были проведены исследования,имеющие целью оптимизацию вируса, экспрессирующего . Метод основывался на отборе обладающих наибольшим диаметром флюоресцирующих бляшек,под агаровым покрытием, в течение 12 пассажей вируса в клеточной культуре. В результате был получен стабильный вариант вектора,характеризующийся, также, более интенсивной экспрессией флюоресцентного белка. Секвенирование штамма показало наличие мутаций в генах РВ 2 РВ 1 РА НА исегменте, где произошла делеция 30 нуклеотидов последовательности 1 перед вставкой . Таким образом, отобранный путем селекции вектор,кодирует перед вставкой 106 -терминальных аминокислотных остатков, характерных для 1 белка вируса гриппа /8 и 10 случайных аминокислотных остатков,образовавшихся вследствие сдвига рамки считывания при делеции. Кроме того, была зафиксирована точечная мутация в позиции 252 самой вставки. Дополнительные исследования показали, что спонтанная генная модификация фрагмента,явилась непосредственной причиной появления стабильной формы антигены -6 и 85 было основано на принципе замены последовательностина последовательность туберкулезного белка. Изобретение иллюстрируется следующими примерами графических изображений. Фиг.1.-схема и нуклеотидная последовательность рекомбинантногогена. Фиг.2.-карта экспрессионной плазмиды 754. Фиг.3.-иммуногенность гриппозного вектора.Результат указан как среднее значениестандартное отклонение. Фиг.4.-выравнивание нуклеотидных последовательностей рекомбинантногогена исходного штамма ТВ- 6 2 85(41) и 12 (42) пассажей на клетках . Фиг.5. - микрофотография гистологических срезов легких мышей 57/6 через 5,5 недель после заражения М. .(А) - легкое невакцинированной мыши 57/6 после заражения М.. Эпителиоидно-клеточная гранулема в очаге альвеолярно-макрофагального гранулематоза, где лимфоциты концентрически группируются вокруг крупного скопления эпителиоидных клеток. Окраска гематоксилином и эозином х 600.(Б) - участок альвеолярно-макрофагальной инфильтрации в легких мыши 57/6,иммунизированной вакцинным препаратом ТВ 6 2 А 85 интраназально. Лимфоидная гранулема. Окраска гематоксилином и эозином х 600. Для лучшего понимания сущности изобретения ниже приводятся примеры его конкретного выполнения. Пример 1. Конструирование рекомбинантного штамма вируса гриппа,экспрессирующего туберкулезные белки -6 и 85. Рекомбинантныйгеномный фрагмент,несущий последовательности,кодирующие микобактериальные белки -6 и 85, был синтезирован и клонирован в двунаправленную экспрессионную плазмиду 754 в компании(Регенсбург, Германия). С целью посттрансляционного разделения -6 белка с терминальной областью 1 белка, между ними была введена синтезированная последовательность(51 нуклеотид), кодирующая участок сайта узнавания клеточными протеазами белка 2 А пикорновируса,который обладает свойством саморазрезания перед последним пролином . ., 1994 68 4486-92. Перед последовательностью, кодирующей белок 85,была введена последовательность,кодирующая-сигнальный пептид иммуноглобулина,обеспечивающий секрецию белка-вставки во внешнюю среду зараженной клетки. Схема и нуклеотидная последовательность рекомбинантногогена представлены на Фиг.1. Фиг.2. Карта экспрессионной плазмиды 754. Плазмиды, кодирующие остальные геномные фрагменты вируса гриппа, за исключением НА,были получены на основе кДНК копий генов,полученных с матрицы вируса, стабильно экспрессирующего, 2004 324 67-73. Таким образом, геном вектора имел происхождение от штамма вируса гриппа //8/34 (11), где НА был заменен на геномный фрагмент штамма вируса гриппа А/утка/Сингапур/-119/97 (53). Клетки(ВОЗ) были получены из Европейской Коллекции Клеточных Культур(,4 0, Великобритания) на 134 пассаже и росли в среде /12 с добавлением 10 фетальной бычьей сыворотки и 2 М -. Для получения рекомбинантного вектора была использована техника трансфекции клеток твттвющимиплзмидми путем электропарации при помощи оборудования. Трансфецированные клетки сеяли в 6-луночные планшеты. Через 6 часов среду заменяли на 4 мл среды -с добавлением 2 М -глутамина и трипсина(1 мкг/мл). Через 2 дня после развития цитопатического эффекта собирали супернатант и использовали его для последующих пассажей в клетках для определения генетической стабильности. Пример 2. Репликативные свойства гриппозного вектораи. Полученный штамм обладал высокой репродуктивной способностью в дефицитной по интерферону клеточной культуре , достигая титров порядка 108-109 БОЕ/мл, и не отличался по этому параметру от вируса гриппа дикого типа. При этом гриппозный вектор не был способен к росту в клеткахи в развивающихся куриных эмбрионах. Предполагалось,что вирусы,экспрессирующие 106 аминокислотных остатков 1 белка и белки-вставки,не могут реплицироваться в организме животных при интраназальном и сублингвальном введении. Мышам линии 57//6 в возрасте 6-8 недель опытных групп под легкой эфирной анестезией вводили 10 мкл интраназально или сублингвально исследуемые препараты в дозе 6,0 ТИД 50/мышь, либо контрольные вирусы гриппа ТИД 50/мышь (10 мкл). В каждой группе было по 15 животных. Забор тканей верхних дыхательных путей и легких осуществлялся на 3-й и 5-й день после иммунизации. Из образцов тканей легких и верхних дыхательных путей были приготовлены 10 гомогенаты на средес помощью дезинтегратора. На 3-й, 5-й и 7-й дни после последнего введения вакцинного препарата или контрольного вируса у 5 животных из каждой группы были собраны ткани легких и верхних дыхательных путей (носовые раковины). Вирусную нагрузку в образцах тканей определяли методом титрования 10 гомогенатом на культуре клеток (впйкя Коллекция Клеточных Культур). Из гомогенатов тканей готовили серии десятикратных разведений на среде(, США) с добавлением 2 глутамина(ТИД 50) использовались 96-луночные культуральные планшеты (, Германия) с суточным монослоем клеток . После удаления среды в лунки наносили по 100 мкл приготовленных разведений вируссодержащего материала. Далее планшеты инкубировали 72-96 часов при температуре 37 С, 5 С 2. Учет результатов проводили визуально по наличию цитопатического эффекта для каждой лунки и контролировали с помощью метода гемагглютинации с использованием 0,5 суспензии куриных эритроцитов. Расчет 50 тканевой инфекционной дозы (ТИД 50) для всех вирусных штаммов проводили по методу Рида и Менча (1938) и выражали вТИД 50/мл. Оценка репликации вакцинного препарата и контрольных вирусов гриппа в верхних дыхательных путях (носовые раковины) и легких мышей на 3-й и 5-й день после иммунизации показала отсутствие вирусовыделения в группах,иммунизированных рекомбинантным гриппозным штаммом при обоих путях введения. Контрольный вирус А/утка/Сингапур/-119/97 был выделен только из носовых турбин только у животных, зараженных интраназально у 3-х из 5 животных на 3-й день после заражения, и у 2-х из 5 на 5 день в титрах ниже 2,5 ТИД 50/мл. Контрольный вирус гриппа//8/34 реплицировался до значительных титров в носовых раковинах у всех животных, инфицированных интраназально, как на 3 день (СГТ 5,33 ТИД 50/мл) так и на 5-й день (СГТ 4,07 ТИД 50/мл) после заражения. Кроме того, на 3-й день после заражения вирус //8/34 был выделен из легких у 2-х из 5 животных. При сублингвальном заражении на 3-й день репликация вируса в верхних дыхательных путях наблюдалась у 2-х из 5 животных и на 5 день - у 3-х из 5-ти. Репликации контрольного вируса //8/34 в легких при сублингвальном введении не наблюдалось. Кроме того, однократная интраназальная или сублингвальная иммунизация не приводила к снижению массы тела и развитию каких-либо клинических симптомов у животных опытных групп. Напротив, в группе контрольных животных,зараженных вирусом гриппа //8/34, было отмечено снижение аппетита, а также потеря массы тела до 15 исходной. Полученные данные позволяют сделать заключение о безопасности рекомбинантного гриппозного вектора,экспрессирующего микобактериальные антигены. Молекулярнобиологические механизмы аттенуации гриппозных векторов и их безвредности для животных могут определяться нарушением функции полноразмерного 1 белка как антагониста системы интерфероновтипа , 1998 726437-6441,а также отсутствием функциональных доменов в карбоксильной части 1 белка, связанных с патогенностью вируса гриппа , 26 . 2006 1-10. Пример 3. Иммуногенные свойства вакцинного кандидата ТВ- 6 2 А 85 Одним из основных механизмов контроля туберкулеза является развитие клеточного Тх-1 иммунного ответа. Предполагалось, что вследствие наличия сигнального пептида иммуноглобулина,обеспечивающего секрецию белков-вставок во внешнюю среду зараженной клетки, полученная конструкция может иметь преимущество в генерации 4 иммунного ответа через представление антигенов с помощью молекул МНСкласса. Мыши линии / 6-недельного возраста (по 4 животных) были иммунизированы интраназально дважды с интервалом 3 недели вакцинным препаратом в дозе 1106 50/животное. Через три недели после второй иммунизации оценивали выработку ИФН-гамма клетками селезенки мышей методом . Для стимуляции использовали рекомбинантный -6 белок (2 мкг/мл,), 201-20, 85101-120 синтетические пептиды(Н-2 рестрицированныйС 4 эпитоп ( 2.0). В качестве отрицательного контроля использовали Н 2-рестрицированный эпитоп белка овальбумина 85101-120 . Последовательная двукратная иммунизация мышей рекомбинантным вирусом, несущим вставку чужеродной последовательности в 528 нуклеотидов,вызвала формирование существенного количества иммунореативных 4 (Тх-1) лимфоцитов селезенки, которые через 3 недели после второй иммунизации были способны отвечать на -6- и 85-специфическую стимуляцию культур спленоцитов иммунизированных мышей продукцией ИФН- (Фиг.3). Фиг.3. Иммуногенность гриппозного вектора. Результат указан как среднее значениестандартное отклонение. Таким образом, была подтверждена способность рекомбинантного гриппозного вектора ТВ 6 2 А 85 индуцировать системный -6 и 85-пцифичный 4 Тх-1 клеточный иммунный ответ при интраназальном введении, что послужило основанием исследования профилактической эффективности вакцинного штамма при экспериментальной туберкулезной инфекции. Пример 4. Генетическая стабильность рекомбинантного штамма - 6 2 85 Полученный штамм был генетически стабильным после множественных пассажей в культуре клеток(10), что было подтверждено секвенированием генетической последовательности 1 рекомбинантного штамма с использованием специфических праймеров 834. Результаты выравнивания нуклеотидных последовательностей рекомбинантногогена исходного штамма - 6 2 85(41) и 12 (42) пассажей на клетках ,показали отсутствие появления мутаций в результате пассирования (Фиг.4). Фиг.4. Выравнивание нуклеотидных последовательностей рекомбинантногогена исходного штамма - 6 2 85(41) и 12 (42) пассажей на клетках . Пример 5. Способ профилактики туберкулеза легких Изучение профилактической эффективности рекомбинантного гриппозного штамма ТВ 6 2 А 85 при сублингвальном и интраназальном путях введения было проведено на мышах 57/6 (в количестве 80 животных). В течение трех недель была проведена подготовка мышей для эксперимента(стандартизация животных по весу) и формирование экспериментальных групп (табл. 1). Таблица 1 Схема эксперимента по оценке профилактического эффекта вакцинного кандидатагр. Подкожно, однократно (106 КОЕ в 0,02 мл) в 1-й день исследования Опытные группы 10 мкл (106 ТИД 50) сублингвально, двукратно с интервалом 3 недели 10 мкл (106 ТИД 50) интраназально, двукратно с интервалом 3 недели На момент окончания эксперимента в группе зараженных нелеченных мышей зарегистрирована гибель 3-х животных (15) с тотальным поражением легочной ткани, в то время как во всех группах вакцинированных мышей гибель от туберкулеза не отмечена. При профилактической вакцинации как вакциной БЦЖ, так вакцинным препаратом ТВ 6 2 А 85 А выявлен протективный эффект различной степени выраженности. Через 3,5 недели от заражения в группе животных,иммунизированных стандартной вакциной БЦЖ,отмечалась тенденция к уменьшению биометрических показателей,выражавшаяся,в частности,в снижении коэффициента массы легких на 10,6, селезенки на 7,8, а также индекса поражения легких - на 4,8 при сравнении с нелеченными инфицированными мышами (табл. 2).. через 6 недель от начала опыта. через 3 недели после второй вакцинации. через 3 недели после второй вакцинации При сублингвальном введении вакцинного препарата выявлена на данном сроке наибольшая эффективность, даже при сравнении с БЦЖ по значимому уменьшению индекса поражения легких на 15,5 (2,290,13 усл. ед. против 2,710,04 усл. ед. в группе контроля заражения, р 0,02). При интраназальном введении вакцинный препарат ТВ- 6 2 А 85 А активным оказался по снижению индекса поражения легких на 12,2 при сравнении с зараженными нелеченными животными (2,460,09 усл. ед. и 2,380,09 усл. ед. против 2,710,04 усл. ед., р 0,05, р 0,01). У препарата ТВ- 6 2 85 также отмечен наиболее низкий, даже по отношению к гр.2 БЦЖ(р 0,05), коэффициент массы селезенки. При исследовании обсемененности легких МБТ, которая является интегральным показателем тяжести течения процесса, протективный эффект обнаружен у всех вакцинированных животных (табл. 2). Таблица 2 Показатели тяжести течения туберкулезной инфекции и высеваемость МБТ из легких у мышей 57/6,профилактически иммунизированных БЦЖ и вакцинным препаратом через 3,5 недели после инфицированияМ. Индекс поражения легких (усл. ед.) числа жизнеспособных бактерий в легких Индекс поражения легких (усл. ед.) числа жизнеспособных бактерий в легких К моменту окончания эксперимента (5,5 недель после заражения), как видно из таблицы 3, у мышей группы контроля заражения произошло дальнейшее прогрессирование туберкулезного процесса по коэффициенту массы легких и индексу их поражения. На фоне большей распространенности туберкулезного процесса у невакцинированных мышей различия с показателями всех вакцинированных животных сохранились на уровне предыдущего срока наблюдения и стали достоверными. Так,при введении БЦЖ регистрировались значимо более низкие биометрические параметры и индекс поражения легких. Коэффициент массы легких в этой группе был ниже в 1,2 раза (2,00,08 усл. ед. против 2,360,12 усл. ед., р 0,05), селезенки - в 1,4 раза(0,810,03 усл. ед. против 1,130,09 усл. ед., р 0,01),ИП легких - в 1,1 раза (2,660,05 усл. ед. против 2,960,04 усл.ед., р 0,001). При сравнении эффективности вакцинного препарата с БЦЖ отмечено, что препарат ТВ 6 2 А 85 при интраназальном применении оказал защитный эффект по коэффициенту массы легких (1,790,11 усл. ед. против 2,360,12 усл. ед.,р 0,001), селезенки (0,760,03 усл. ед. против 1,130,09 усл. ед., р 0,001) и индексу поражения легких (2,390,06 усл. ед. против 2,960,04 усл.ед.,р 0,001). Степень распространенности поражения легких при этом была на уровне, достоверно более низком, чем у мышей, вакцинированных БЦЖ Показатели тяжести течения туберкулезной инфекции и высеваемость МБТ из легких у мышей 57/6,профилактически иммунизированных БЦЖ и вакцинным препаратом ТВ- 6 2 85 через 5,5 недель после инфицированияМ.гр. Индекс поражения легких (усл. ед.) числа жизнеспособных бактерий в легких По результатам гистологического исследования в группе зараженных невакцинированных мышей(контроль заражения) при оценке срезов легких было выявлено большое количество свежих инфильтративных изменений в легочной паренхиме. Очаги инфильтрации в основном были некрупные,местами сливающиеся, с размытыми границами без четкой пространственной ориентации клеток. При этом инфильтрация альвеол и межальвеолярных перегородок клетками лимфоцитарномакрофагального ряда наблюдалась на фоне серозной и фибринозной экссудации. Во всех срезах в инфильтратах мышей контроля заражения отмечены нейтрофильные лейкоциты и их скопления - маркеры альтерации легочной ткани, 7 которые в 2-х из 6 случаев частично распадались и образовывали ядерный детрит (Фиг.5 А). Фиг.5. - Микрофотография гистологических срезов легких мышей 57/6 через 5,5 недель после заражения М. .(А) - легкое невакцинированной мыши 57/6 после заражения М. . Эпителиоидно-клеточная гранулема в очаге альвеолярно-макрофагального гранулематоза, где лимфоциты концентрически группируются вокруг крупного скопления эпителиоидных клеток. Окраска гематоксилином и эозином х 600.(Б) - участок альвеолярно-макрофагальной инфильтрации в легких мыши 57/6,иммунизированной вакцинным препаратом ТВ 6 2 А 85 интраназально. Лимфоидная гранулема. Окраска гематоксилином и эозином х 600. В то же время в очагах альвеолярномаркофагального гранулематоза в 2 из 6 случаев обнаружены и гранулемы - плотные очаги инфильтрации с четкими границами, где лимфоциты концентрически расположены вокруг очень крупных скоплений эпителиоидных клеток. Некоторые гранулемы содержали нейтрофильные лейкоциты и их скопления. Периваскулярная и перибронхиальная инфильтрация выражена очень слабо, поскольку крупных лимфогистиоцитарных инфильтратов вокруг бронхов и сосудов не зарегистрировано. Профилактическая иммунизация вакцинным препаратом ТВ- 6 2 А 85 как при интраназальном, так и при сублингвальном введении наиболее существенно отразилась на распространенности специфического поражения легких и активности местной лимфоидной реакции. Так ни у одной мыши из экспериментальных групп 3 и 4 не наблюдалось распространенного поражения(более чем на 30 площади срезов), у всех животных участки инфильтрации были небольшими, часто располагались периваскулярно и перибронхиально, и не имели выраженного экссудативного компонента (Фиг.5 Б). Ни в одном срезе среди лимфоцитов,макрофагов и эпителиоидных клеток не обнаружено нейтрофильных гранулоцитов, что свидетельствует об отсутствии признаков альтерации. Преимущественно лимфоидный состав гранулем и выраженная периваскулярная лимфогистиоцитарная инфильтрация, свидетельствуют о напряженности местного клеточного иммунитета легочной ткани и,отражают обеспечение протективного эффекта вакцинного кандидата. ФОРМУЛА ИЗОБРЕТЕНИЯ Рекомбинантный штамм вируса гриппа ТВ 6 2 85, депонированный в РГП Научноисследовательский институт проблем биологической безопасности КН МОН РК, под регистрационным номером
МПК / Метки
МПК: A61K 39/145, C12N 7/00
Метки: штамм, тb-flu, ag85a, esat6, вируса, рекомбинантный, использование, гриппа, профилактики, туберкулеза
Код ссылки
<a href="https://kz.patents.su/12-ip28077-rekombinantnyjj-shtamm-virusa-grippa-tb-flu-esat6-2a-ag85a-i-ego-ispolzovanie-dlya-profilaktiki-tuberkuleza.html" rel="bookmark" title="База патентов Казахстана">Рекомбинантный штамм вируса гриппа ТB-FLU Esat6 2A Ag85A. и его использование для профилактики туберкулеза</a>