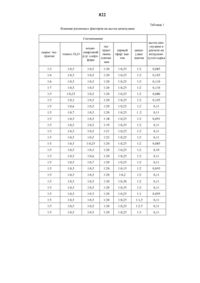
Способ выделения 8-[2,3-бис(гидроксиметил)акрилоилокси]-гвай-1(10), 4(14), 11(13)-триен-6, 12-олида
Номер патента: 822
Опубликовано: 15.06.1994
Авторы: Адекенов Сергазы Мынжасарович, Кадирберлина Гульпан Мусралиевна
Формула / Реферат
Изобретение относится к гетероциклическим соединениям, в частности к 8-[2,3-бис (гидроксиметил) акрилоилокси]-гвай-1 (10), 4 (14), 11 (13)-триен-6,12-олиду (цепсеудин), который обладает антимикробной и фунгицидной активностью. Цель изобретения - разработка способа получения нового соединения, обладающего указанными свойствами. Получение цепсеудина ведут из растительного сырья. Подземную часть василька ложнопятнистого Centaurea pseudomaculosa Dobrocz подвергают экстракции хлороформом при соотношении сырье-экстрагент 1:(4-7). Экстракт обрабатывают смесью этанол-вода 1:(0,3-0,7) с последующим извлечением хлороформом при соотношении раствор-хлороформ 1:(0,3-0,7), хроматографированием смолки на колонке с нейтральной окисью алюминия элюированием ацетоном при соотношении продукт-ацетон 1:(3-3) и выделением целевого цепсеудина. Активность цепсеудина в 2,6-5 раз выше активности фенола.
Текст
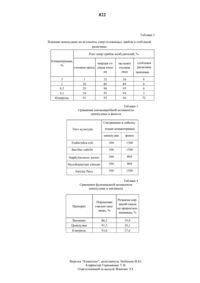
НАЦИОНАЛЬНОЕ ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(73) Научно-производственное внедренческое малое предприятие ТАБИГАТ, С.М. Адекенов(57) Изобретение относится к гетероциклическим соединениям, в частности к 8-2,3-бис (гидроксиметил) акрилоилокси-гвай-1 (10), 4 (14), 11 (13) триен-6,12-олиду (цепсеудин), который обладает антимикробной и фунгицидной активностью.Цель изобретения - разработка способа получения нового соединения, обладающего указанными свойствами.Получение цепсеудина ведут из растительного сырья. Подземную часть василька ложнопятнистого Сетаитеа р 5 еи 1 отаси 1 о 5 а ВоЬтос 2 подвергают экстракции хлороформом при соотношении сь 1 рье-экстрагент 1(4-7). Экстракт обрабать 1 вают смесью этанол-вода 1(0,3-0,7) с последующим извлечением хлороформом при соотношении раствор-хлороформ 1(0,3-0,7), хроматографированием смолки на колонке с нейтральной окисью алюминия элюированием ацетоном при соотношении продукт-ацетон 1(3-3) и вь 1 делением Целевого цепсеудина. Активность цепсеудина в 2,6-5 раз выше активности фенола.8-2,3-бис (гидроксиметил) акрилоилоксигвай-1 (10), 4 (14),11 (13)-триен-6,12-олид (цепсеудин) является новым сесквитерпеновым лактоном гваянового типа, обладает антимикробной и фунгицидной активностью и может бьгть использован в качестве пестицидного средства для борьбы с грибковыми заболеваниями сельскохозяйственных культур.Цель изобретения - разработка способа выделения из растительного сырья нового химического соединения - цепсеудина, обладающего антимикробной и фунгицидной активностью при низкой токсичности.Пример. 1,8 кг цветочных корзинок и листьев василька ложнопятнистого Сетаитеа р 5 еис 1 отаси 1 о 5 а ВоЬтос 2 экстрагируют хлороформом при соотношении сырье-экстратент 15. Полученную после отгонки растворителя (хлороформ) сиропообразную массу темно-зеленого цвета (118 г) обрабатывают смесью этанол-вода 120,5. При этом выпадает осадок (белковые компоненты, хлорофилл), который отделяют декантацией. Из водноспиртовой смеси целевой продукт извлекают хлороформом при соотношении водно-спиртовой смеси и хлороформа 120,4. Оставшуюся после упаривания хлороформа сиропообразную массу кремового цвета (54 г) хроматографируют на колонке с носителем нейгральной окисью алюминия(степени активности 111) при соотношении сумманоситель 120. Последовательно элюируют смесью гексан-бензол (121), бензолом, смесью бензол-эфир (421 121), эфиром, смесью эфирэтилацетат (421 121), этилацетатом, смесью этилацетат-ацетон (421 121), ацетоном. Собирают отдельно каждую фракцию по 250 мл. Из ацетоновых фракций получают цепсеудин в виде кристаллизующейся массы (по ТСХ имеет одно пятно с Кд-0,53), которую промывают смесью серный эфир-ацетон (120,25) и перекристаллизовывают из спирта. Полученный целевой продукт 8-2,3-бисВ табл. 1 приведены примеры осуществления способа выделения цепсеудина в различных условиях.Цепсеудин хорошо растворим в спирте, хлороформе, ацетоне, диметилсульфоксиде. Необходимо хранить в темном месте. В ИК-спектре цепсеудина наблюдаются полосы поглощения в области 3360-3250 (-ОН), 1760 (карбонил у-лактона), 1710, 1260 (сложноэфирная группа),1660 см (сс).В ПМР-спектре цепсеудина синглет при 1,47 м.д. (ЗН) соответствует протонам метила при двойной связи, сигнал в области 3,16 м.д. (1 Н)-Н 5, квартет при 4,02 м.д. (1 Н, 14 9 Гц, 1215 Гц)-Н 8, дублет дублетов при 4,30 м.д. (1 Н)-лактонному протону, дублеты в области 5,88 и 6,28 м.д. (по 1 Н каждый, 15 Гц) относятся к протонам экзоциклической метиленовой группы, сопряженной с карбонилом у-лактона, дублет при 6,48 м.д. (2 Н,17,5 Гц) - протонам экзоциклической метиленовой группы в углеродном скелете. Наличие осметилен-у-лактонного цикла подтверждает также УФ-спектр, в котором отмечен максимум при 215 нм (а 9500).При щелочном гидролизе 4-ным раствором КОН цепсеудина с последующим подкислением 10 -ной Н 2 О 4 образуется оксилактон (Н) состава (С 15 Н,8 О 3 с т. пл. 159-161 (бензол-ацетон, 124),в ИК-спектре которого отсутствует полоса поглощения, характерная для сложноэфирной группы.При взаимодействии соединения 1 с морфолином образуется производное (Ш) состава С 14 Н 33 О 7 М ст. пл. 131-133 (бензол-ацетон).Антибактериальная активность цепсеудина проверялась на тест-культурах микроорганизмов Е 5 с 11 ег 1 с 111 а со 11, Вас 111 и 5 511 Ьт 1115, тар 11 у 1 ососси 5 аигеиз, Мисоьастетйит сйтегеит, Загсйпа Пауа.Антимикробное действие цепсеудина определено методом серийных разведений. Концентрация цепсеудина 10 - 0,000 мкг/мл. В качестве позитивного контроля использован фенол.Результаты исследований показали, что цепсеудин подавляет рост всех указанных тесткультур при концентрации 300 мкг/мл. Активность цепсеудина превышает активность фенола по отношению к стафилококкам и микробактериям в 2,6 раза, по отношению к остальным тесткультурам - в 5 раз.Фунгицидную активность на всхожесть спор грибов-возбудителей пыльной головни овса,обыкновенной головни проса, твердой головниячменя и стеблевой ржавчины пшеницы определяют следующим образом. В чашки Петри на 0,5-ную агаровую среду наносят водный раствор цепсеудина различной концентрации (5,1, 0,5, 0,1). Затем на нанесенный раствор высевают споры грибов-возбудителей пыльной головни овса, обыкновенной головни проса, твердой головни ячменя и стеблевой ржавчины. Контролем служат споры, проращиваемые в чистой воде. Повторность опытов трехкратная. Чашки с биоматериалом (спорами) выдерживают в течение суток при оптимальной для спор температуре 1820 С. По истечении суток результаты всхожести снимают под микроскопом. В каждой повторности для учета берут 100 спор.Результаты испытания показали, что цепсеудин при 5-ной концентрации ингибирует развитие твердой головни ячменя и пыльной головни овса на 64-68 и полностью подавляет рост спор головни проса. При 0,5-ной концентрации ОН полностью ингибирует развитие спор стеблевой ржавчины пшеницы (см. табл. 2).Результаты полевых испытаний показали,что цепсеудин снижает распространение корневой гнили у яровой пшеницы Саратовская - 29 и задерживает развитие у нее болезни. По эффективносги действия не уступает эталонному препарату витаваксу.Ценным качеством цепсеудина оказалось его отрицательная мутагенная активность.Мутагенная активность проверена на штаммах а 1 топе 11 а турпйтигйит ТА 1535 и ТА 1538. При концентрации 1-1000 мкг/мл цепсеудин мутагенного действия не проявляет. Следовательно,цепсеудин не влияет на физиологию развития растений и не оказывает побочного отрицательного действия.Токсичность цепсеудина определена на белых беспородных мышах путем введения вещества в виде 40-50 -ной масляно-спиртовой эмуль сии. Установлено, что ЛД 50 составляет 3078279,6 мг/кг. В соответствии с ГОСТом12.1.007-76 Вредные вещества. Классификация и общие требования к безопасности цепсеудин относится к умеренно опасным соединениям.Сравнение антимикробной и фунгицидной активности цепсеудина проведено с эталонными препаратами фенолом и витаваксом. Данные по результатам испытаний сведены в табл. 3 и 4.Цепсеудин обладает высокой антибактериальной активностью в отношении Е 5 с 11 ег 1 с 111 а со 11,Вас 111 и 5 511 Ьт 1115, тар 11 у 1 ососси 5 аигеиз, МусоЬастегйит сйпеит, Загсйпа Пауа (эффективность действия цепсеудина в 2,6-5 раза выше действия фенола), выраженной фунгицидной активностью против стеблей ржавчины и корневой гнили яровой пшеницы Саратовская - 29 не уступает по эффективности действия эталонному препарату витаваксу и способствует повышению урожайности пшеницы при малой токсичности.отличающийся тем, что подземную часть василька ложнопятнистого Сетаитеа р 5 еис 1 отаси 1 о 5 а ВоЬгос 2 подвергают экстракции хлороформом при соотношении сырье-экстрагент 1(4-7) с последующей обработкой экстракта смесью этанол-вода, взятых в соотношении 1(0,3-0,7), извлечением из водно-спиртового раствора хлороформом при соотношении раствор-хлороформ 1(0,3-0,7), хроматографированием смолки на колонке с нейтральной окисью алюминия, алюированием ацетона при соотношении продукт-ацетон 1(1-3) и выделением целевого продукта.Таблица 1 Влияние различных факторов на выход цепсеудина Соотношение выход цепВОДНФ экс- сеудина в тракт серный цепсе- расчете на сырье. экс- спиртовои этанол. Н 2 О окись эфир. аце- удин. воздушнотают р-р Хлоро- алюми- тон ацетон сухое сырье форм ния 13 120,5 120,5 120 120,25 122 0,085 124 120,5 120,5 1220 120,25 122 0,105 126 120,5 120,5 1220 120,25 122 0,110 127 120,5 120,5 1220 120,25 122 0,110 125 120,25 120,5 1220 120,25 122 0,080 125 120,3 120,5 1220 120,25 122 0,105 125 120,6 120,5 1220 120,25 122 0,11 125 120,7 120,5 1220 120,25 1 22 0,11 125 120,5 120,5 1218 120,25 122 0,091 125 120,5 120,5 1219 120,25 122 0,11 125 120,5 120,5 1221 120,25 122 0,11 125 120,5 120,5 1222 120,25 122 0,11 125 120,5 120,25 1220 120,25 122 0,085 125 120,5 120,3 1220 120,25 122 0,10 125 120,5 120,6 1220 120,25 122 0,11 125 120,5 120,7 1220 120,25 122 0,11 125 120,5 120,5 1220 120,15 122 0,093 125 120,5 120,5 1220 120,2 122 0,11 125 120,5 120,5 1220 120,30 122 0,11 125 120,5 120,5 1220 120,35 122 0,11 125 120,5 120.5 1220 120,25 121 0,095 125 120,5 120,5 1220 120,25 121,5 0,11 125 120,5 120,5 1220 120,25 122.5 0,11 125 120,5 120,5 1220 120,25 123 0,11
МПК / Метки
МПК: C07D 307/80, A01N 43/08
Метки: 12-олида, выделения, способ, 11(13)-триен-6, 4(14, 8-[2,3-бис(гидроксиметил)акрилоилокси]-гвай-1(10
Код ссылки
<a href="https://kz.patents.su/5-822-sposob-vydeleniya-8-23-bisgidroksimetilakriloiloksi-gvajj-110-414-1113-trien-6-12-olida.html" rel="bookmark" title="База патентов Казахстана">Способ выделения 8-[2,3-бис(гидроксиметил)акрилоилокси]-гвай-1(10), 4(14), 11(13)-триен-6, 12-олида</a>
Предыдущий патент: Способ оценки молочной продуктивности кобыл в мясном коневодстве
Следующий патент: Машина для выделения семян из плодов бахчевых
Случайный патент: Способ ремонта повреждений покрышек