Способ определения жизнеспособности клеток в суспензии культуры клеток Solanum tuberosum
Номер патента: 22180
Опубликовано: 14.12.2012
Авторы: Жабаева Динара Болатпековна, Утарбаева Айжан Шарельевна, Михалев Александр Николаевич, Кунаева Рауза Минлиахмедовна, Сапко Ольга Александровна
Формула / Реферат
Изобретение относится к области био-технологии растений и может быть использовано при характеризации культур растительных клеток.
Технический результат, обеспечиваемый изобретением, выражается в повышении точности определения жизнеспособности культуры расти-тельных клеток, снижении трудозатрат и затрат времени на проведение испытания.
Способ определения жизнеспособности клеток в суспензии культуры клеток Solanum tuberosum , включающий то, что клетки предварительно окрашивают и определяют соотношение живых и погибших клеток в суспензии на основании разницы в способности их сорбировать краситель достигается тем, что определение жизнеспособности проводят спектрофотометрическим методом, в качестве красителя используют метиленовый синий, 0,1% водным раствором которого воздействуют на суспензию культуры клеток solanum tuberosum в соотношении 5:1(v/v) в течение 5мин, избыток которого после окрашивания отмывают водой, отфильтрованные окрашенные клетки экстрагируют 20% раствором уксусной кислоты в этиловом спирте, в полученных экстрактах красителя измеряют адсорбцию света при длине волны 660нм.
Текст
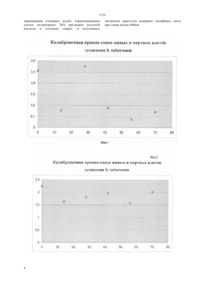
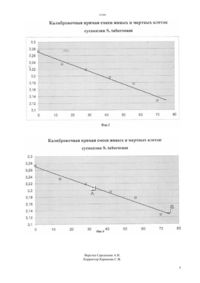
(51) 12 5/04 (2012.01) 12 5/02 (2012.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ СУСПЕНЗИИ КУЛЬТУРЫ КЛЕТОК(57) Изобретение относится к области биотехнологии растений и может быть использовано при характеризации культур растительных клеток. Технический результат,обеспечиваемый изобретением, выражается в повышении точности определения жизнеспособности культуры растительных клеток, снижении трудозатрат и затрат времени на проведение испытания. Способ определения жизнеспособности клеток в суспензии культуры клеток,включающий то, что клетки предварительно окрашивают и определяют соотношение живых и погибших клеток в суспензии на основании разницы в способности их сорбировать краситель достигается тем, что определение жизнеспособности проводят спектрофотометрическим методом, в качестве красителя используют метиленовый синий,0,1 водным раствором которого воздействуют на суспензию культуры клетокв соотношении 51(/) в течение 5 мин, избыток которого после окрашивания отмывают водой,отфильтрованные окрашенные клетки экстрагируют 20 раствором уксусной кислоты в этиловом спирте, в полученных экстрактах красителя измеряют адсорбцию света при длине волны 660 нм.(72) Михалев Александр Николаевич Сапко Ольга Александровна Утарбаева Айжан Шарельевна Жабаева Динара Болатпековна Кунаева Рауза Минлиахмедовна(73) Дочернее государственное предприятие на праве хозяйственного ведения Институт молекулярной биологии и биохимии им. М.А.Айтхожина Республиканского государственного предприятия на праве хозяйственного ведения Центр биологических исследований Министерства образования и науки Республики Казахстан(54) СПОСОБ ОПРЕДЕЛЕНИЯ ЖИЗНЕСПОСОБНОСТИ КЛЕТОК В Способ определения жизне-способности клеток в суспензии культуры клетокотносится к области биотехнологии растений и может быть использовано при характеризации культур растительных клеток. Известен способ определения жизнеспособности клеток в суспензии культуры растительных клеток,включающий то, что суспензию культуры клеток предварительно окрашивают красителем метиленовым синим и определяют соотношение количества окрашенных и неокрашенных клеток путем их визуального подсчета в поле зрения микроскопа . Жизнеспособность клеток определяют по их окрашиванию красителем (метиленовый синий или синий Эванса). Живые клетки неокрашиваются красителем вследствие непроницаемости для него клеточных мембран. В мертвые клетки краска легко проникает, и они окрашиваются в синий цвет. В соответствии с прототипом проводят следующее 1. Готовят препарат суспензии, встряхивают суспензию в колбе, пипеткой отбирают небольшое количество суспензии, помещают каплю суспензии на предметное стекло, добавляют каплю красителя,накрывают покровным стеклом, излишки жидкости убирают фильтровальной бумагой. 2. Помещают препарат на столик микроскопа под малое увеличение объектива и подсчитывают клетки в 3-х полях зрения (просмотривают не менее трех препаратов). 3. Результаты записывают в таблицу. 4. Делают вывод о жизнеспособности суспензии(количестве неокрашенных клеток,) Сельскохозяйственная биотехнология Учеб/. Шевелуха В.С. с.29. Калашникова Е.А., Воронин Е.С и др Под ред. Шевелухи . - 2-е изд., перераб. и доп.М. Высш. шк., 2003. с.469 ил. с.94 Основы биотехнологии растений. Культура клеток и тканей. Учебное пособие / Составители Сорокина И.К.,Старичкова Н.И., Решетникова Т.Б., Гринь Н.А. с.27. Недостатком данного способа является то, что метод требует длительного времени для исполнения и значительных трудозатрат, а также мало пригоден при анализе культур клеток с повышенной степенью агрегации. Задачей изобретения является разработка быстрого, точного, с минимальными трудозатратами и затратами рабочего времени метода определения жизнеспособности клеток в суспензии культуры растительных клеток, в том числе агрегированных культур. Поставленная задача, достигается тем, что в качестве красителя используют метиленовый синий,0,1 водным раствором которого воздействуют на суспензию культуры клетокв соотношении 51(/) в течение 5 мин, отмывают избыток красителя водой,отфильтрованные окрашенные клетки экстрагируют 20 раствором уксусной кислоты в этиловом спирте, в полученных экстрактах красителя измеряют адсорбцию света при длине волны 660 нм. 2 Культуру клетокиспользуют для испытания средств защиты растений, ростстимулирующих веществ,цитотоксической активности паразитов картофеля и др. препаратов,для получения посадочного материала картофеля свободного от патогенов, для селекционных работ. Культуру клеток культивируют на среде - при оптимальной температуре в аэробных условиях,хранят при температуре 4-6 С в течение 3-4 недель,максимальная продолжительность сохранения жизнеспособности 7-8 недель, при хранении происходит остановка роста,свойства не изменяются. Пример 1. Культуру клетокс циклом выращивания 7-8 дней при исходной плотности засева 0,5-0,7105 кл/см 3 и культивирования на модифицированной средепри температуре 24-27 С анализировали в середине цикла выращивания (на 4-й день). Плотность клеток суспензии определяли после мацерации суспензии 20 хромовой кислотой в течение 15 минут при температуре 60 С. Жизнеспособность клеток под микроскопом оценивали по прижизненной окраске 0,1 раствором метиленового синего (11) подсчетом в гомоцитометре Фукса-Розенталя. При каждом подсчете просматривали около 1000 клеток. Пример 2. Суспензию клеток .с жизнеспособностью 70-75 разделяли на 2 равные части с одинаковой плотностью клеток (1,2105 кл/мл). В первой части была вызвана тотальная гибель клеток путем инкубирования суспензии в 10 растворев течение 1 часа. Суспензию мертвых клеток смешивали с клетками исходной суспензии в следующих соотношениях ( об.) 1000 8020 6040 4060 2080 и 0100. Полученные смеси окрашивали путем добавления 0,1 раствора метиленового синего в соотношении 51(/) и инкубирования с красителем в течение 5 мин. Окрашенные клетки отмывали от избытка красителя с помощью вакуум фильтрационной системы через мембранный фильтр три раза четырехкратным объемом дистиллированной воды. Клетки количественно собирали с мембранного фильтра и краситель экстрагировали 20 раствором уксусной кислоты в этиловом спирте при периодическом перемешивании в течение 15 минут. Клетки отделяли. Пример 3. В полученных окрашенных растворах измеряли адсорбцию света при длине волны 290 нм. Опыты воспроизведены дважды, в трехкратной повторности каждый. Средние арифметические значения были нанесены на график. Полученный график представлен на фиг.1. Как видно из фиг.1 смеси с различным содержанием живых и мертвых клеток не образуют прямую зависимость между процентным содержанием погибших клеток в смеси и значением адсорбции света при длине волны 290 нм в окрашенных растворах,полученных экстрагированием красителя метиленового синего из суспензии предварительно окрашенных клеток. Полученный график непригоден для использования его в качестве калибровочной прямой при определении жизнеспособности клеток суспензии. Пример 4. В полученных окрашенных растворах измеряли адсорбцию света при длине волны 330 нм. Опыты воспроизведены дважды, в трехкратной повторности каждый. Средние арифметические значения были нанесены на график. Полученный график представлен на фиг.2. Как видно из фиг.2 смеси с различным содержанием живых и мертвых клеток не образуют прямую зависимость между процентным содержанием погибших клеток в смеси и значением адсорбции света при длине волны 330 нм в окрашенных растворах,полученных экстрагированием красителя метиленового синего из суспензии предварительно окрашенных клеток. Полученные график не позволяет использовать его в качестве калибровочной прямой при определении жизнеспособности клеток суспензии. Пример 5. В полученных окрашенных растворах измеряли адсорбцию света при длине волны 660 нм. Опыты воспроизведены дважды, в трехкратной повторности каждый. Средние арифметические значения были нанесены на график, где расположились вблизи прямой линии. Через них методом линейного сглаживания была проведена калибровочная прямая (мастер диаграмм,мастер построения линии тренда). Полученная калибровочная прямая приведена на фиг.3. Как видно из фиг.3 смеси с различным содержанием живых и мертвых клеток образуют прямую зависимость между процентным содержанием погибших клеток в смеси и значением адсорбции света при длине волны 660 нм в окрашенных растворах,полученных экстрагированием красителя метиленового синего из суспензии предварительно окрашенных клеток. Полученные график позволяет использовать его в качестве калибровочной прямой при определении жизнеспособности клеток суспензии. Пример 6. Для проверки диагностической ценности спектрофотометрического метода было выращено 2 суспензии культуры клеток. Первая суспензия была взята на 4 сутки роста. Вторая суспензия была взята на 6 сутки роста. Плотность клеток суспензии определяли подсчетом в гомоцитометре Фукса-Розенталя после мацерации суспензии 20 хромовой кислотой в течение 15 минут при температуре 60 С. Обе суспензии с помощью разбавления были доведены до плотности 1,2105 кл/мл. Для каждой суспензии была определена жизнеспособность клеток. Жизнеспособность клеток под микроскопом оценивали по прижизненной окраске 0,1 раствором метиленового синего (11) 2. При каждом подсчете просматривали около 1000 клеток. Обе суспензии окрашивали путем добавления 0,1 раствора метиленового синего в соотношении 51 (/) и инкубирования с красителем в течение 5 мин. Окрашенные клетки отмывали от избытка красителя с помощью вакуум фильтрационной системы через мембранный фильтр три раза четырехкратным объемом дистиллированной воды. Клетки количественно собирали с мембранного фильтра и краситель экстрагировали 20 раствором уксусной кислоты в этиловом спирте при периодическом перемешивании в течение 15 минут. Клетки отделяли. В полученных окрашенных растворах измеряли адсорбцию света при длине волны 660 нм. Значения адсорбции света откладывали на графике калибровочной прямой и по шкале абсцисс определяли процентное содержание живых клеток в суспензии (фиг.4). Полученные данные приведены в таблице 1. Результаты спектрофотометрического определения их жизнеспособности оказались в хорошем соответствии с микроскопическим определением. Таким образом, спектрофотометрический метод определения жизнеспособности культуры клеток существенно быстрее микроскопического и более достоверен при анализе агрегированных культур. Разработанный спектрофотометрический метод определения жизнеспособности представляет собой удобный вариант для скрининговых исследований. Таблица 1 Сравнительная проверка жизнеспособности суспензии культуры клетокмикроскопическим и спектрофотометрическим методами Суспензии культуры клеток Определение жизнеспособностиМикроскопически,Спектрофотометрически,живых клеток живых клеток Суспензия А 30 32 Суспензия Б 15 74 ФОРМУЛА ИЗОБРЕТЕНИЯ Способ определения жизнеспособности культуры клетоквключающий то, что клетки предварительно окрашивают и определяют соотношение живых и погибших клеток в суспензии на основании разницы в способности их сорбировать краситель, отличающийся тем, что определение жизнеспособности проводят спектрофотометрическим методом, в качестве красителя используют метиленовый синий, 0,1 водным раствором которого воздействуют на суспензию культуры клетокв соотношении 51(/) в течение 5 мин, избыток которого после 3 окрашивания отмывают водой, отфильтрованные клетки экстрагируют 20 раствором уксусной кислоты в этиловом спирте, в полученных экстрактах красителя измеряют адсорбцию света при длине волны 660 нм.
МПК / Метки
Метки: клеток, суспензии, tuberosum, solanum, определения, культуры, способ, жизнеспособности
Код ссылки
<a href="https://kz.patents.su/5-22180-sposob-opredeleniya-zhiznesposobnosti-kletok-v-suspenzii-kultury-kletok-solanum-tuberosum.html" rel="bookmark" title="База патентов Казахстана">Способ определения жизнеспособности клеток в суспензии культуры клеток Solanum tuberosum</a>
Предыдущий патент: Способ и устройство для бурения скважин
Следующий патент: Способ разделения неустойчивых водонефтяных эмульсий
Случайный патент: Хронопотенциометр