Олигопептид, конъюгат, обладающий противораковой активностью, который включает названный олигопептид
Номер патента: 9701
Опубликовано: 15.01.2003
Авторы: ОЛИФФ, Аллен И., ФЕНГ, Донг-Мей, ГАРСКИ, Виктор М., ДеФЕО-ДЖОНС, Дебора, ДЖОНС, Раймонд Е.
Формула / Реферат
Èçîáðåòåíèå îòíîñèòñÿ ê олигопептидам, которые имеют аминокислотную последовательность, распознаваемую и протеолитически расщепляемую свободным простатическим антигеном (PSA). Описаны также анализы, в которых указанные олигопептиды могут быть использованы для in vitro- и in vivo-определения протеазной активности свободного PSA. Кроме того, раскрываются терапевтические агенты, содержащие конъюгаты указанных олигопептидов и известных цитотоксических агентов.
Текст
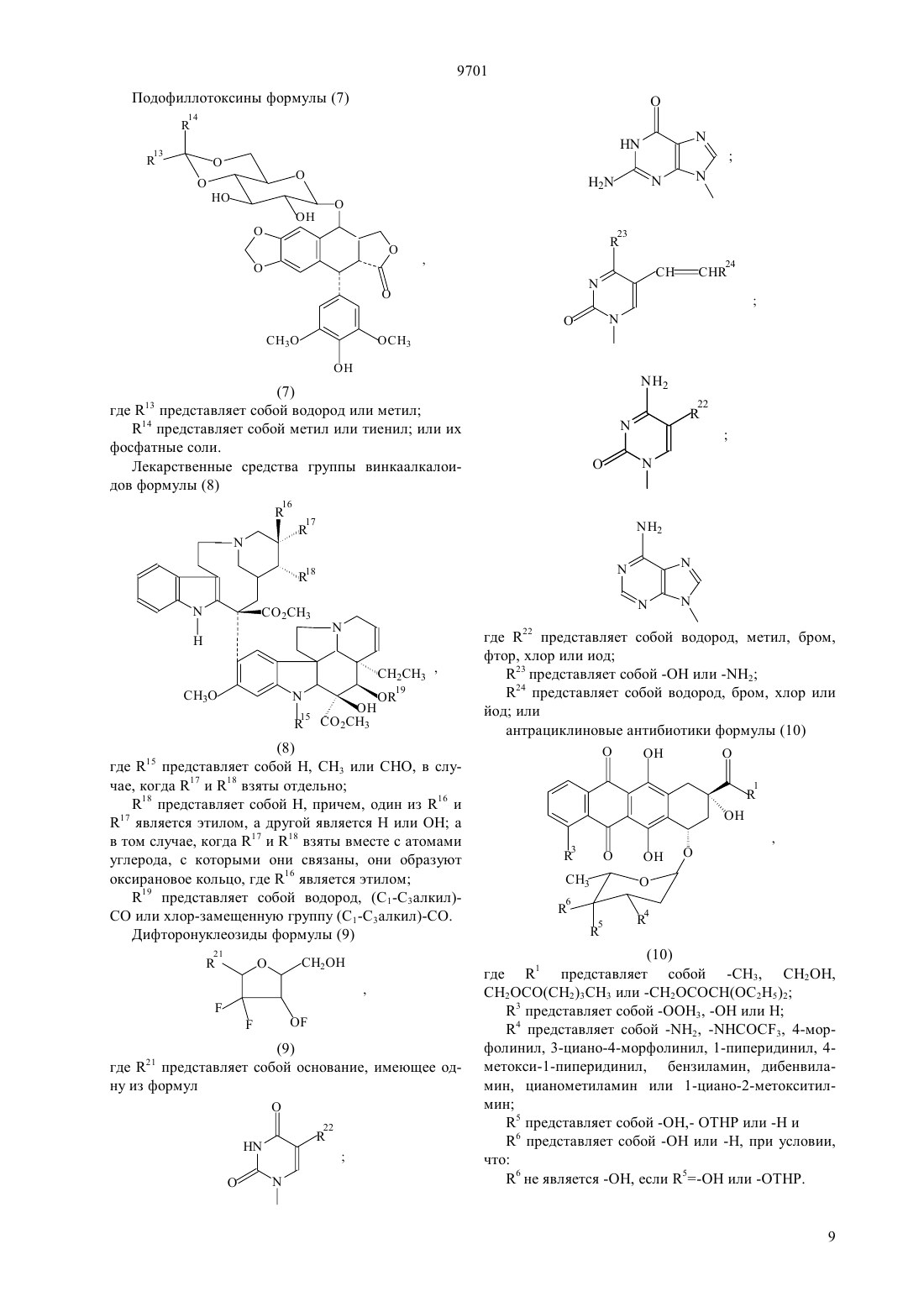
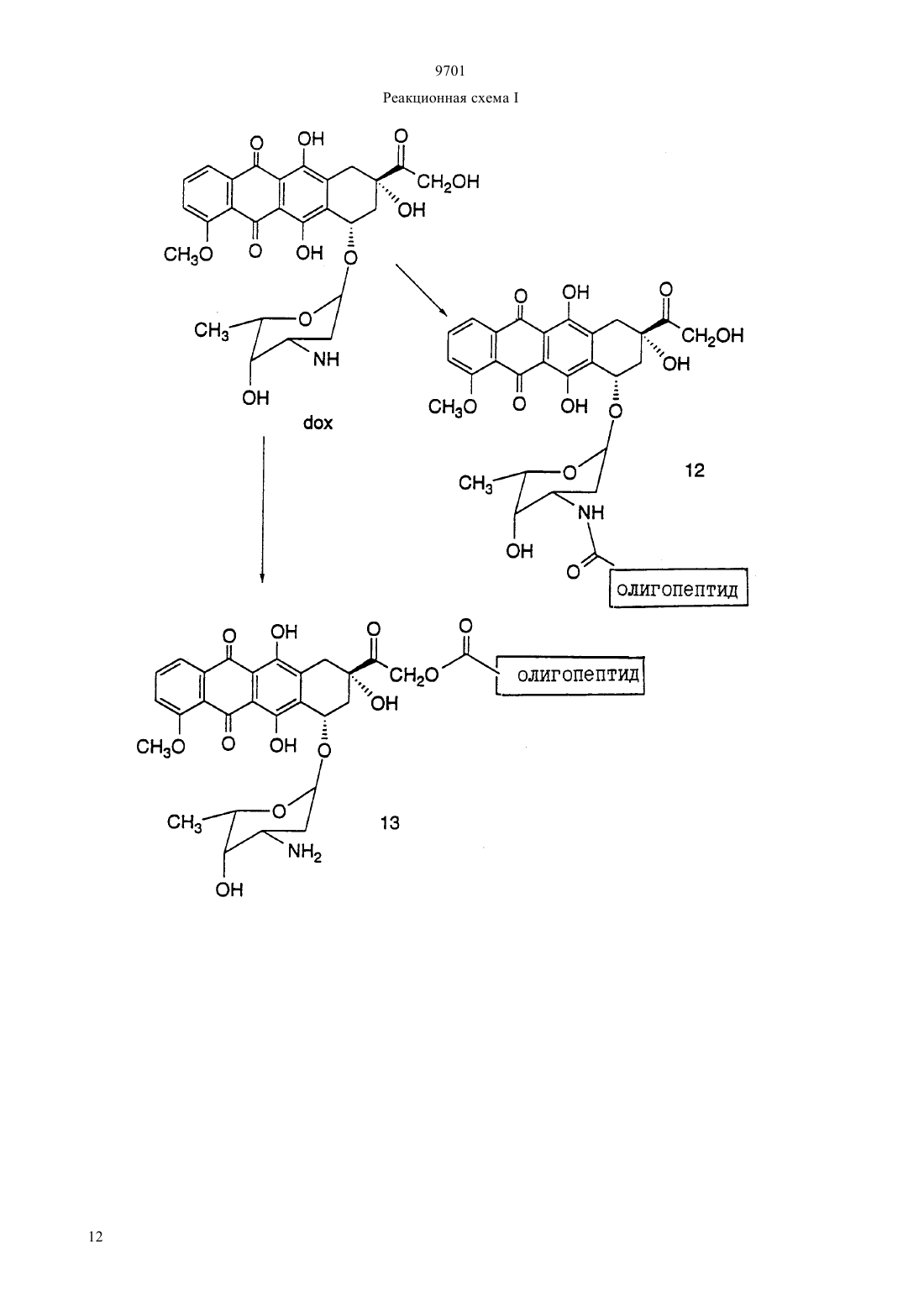
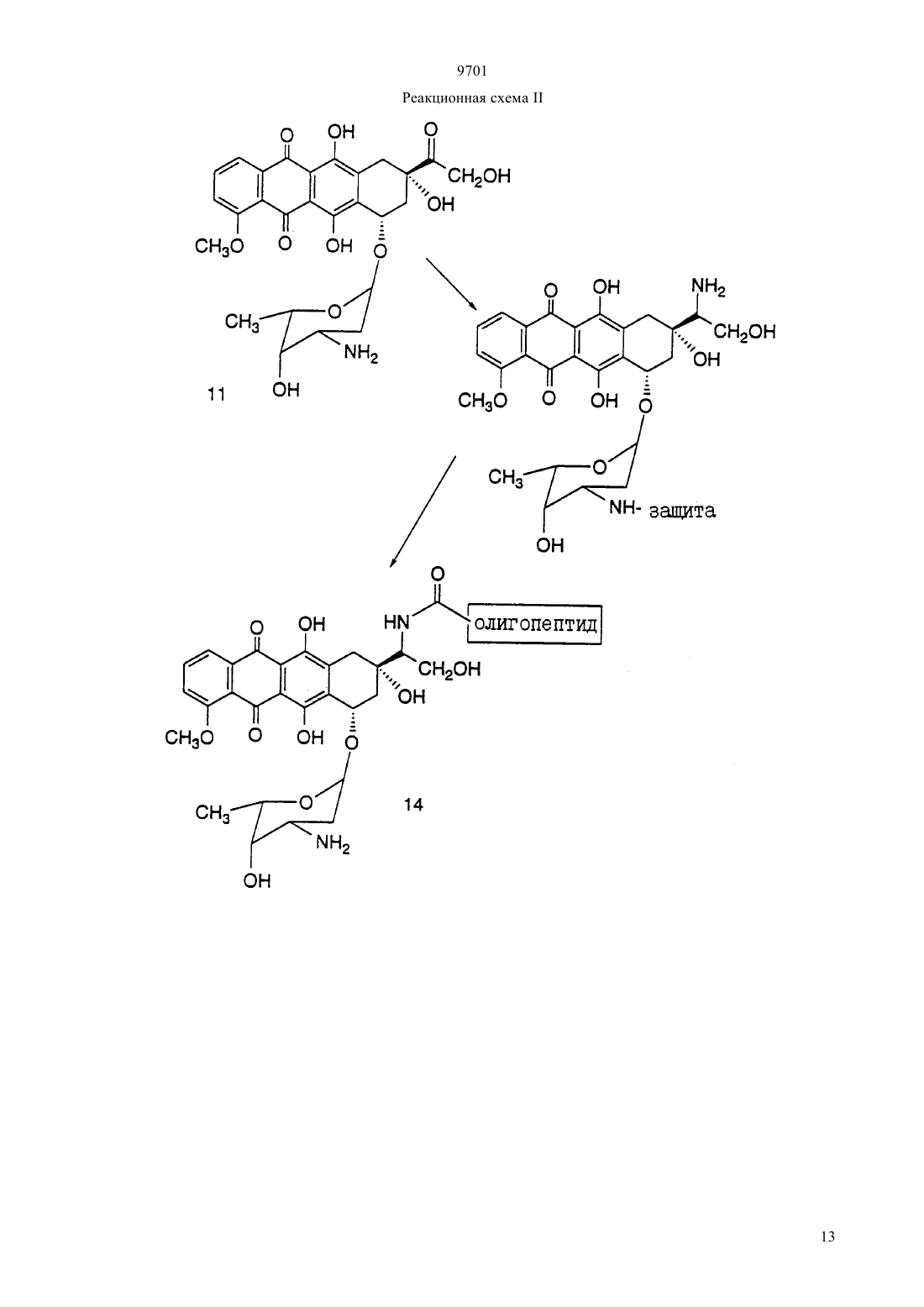
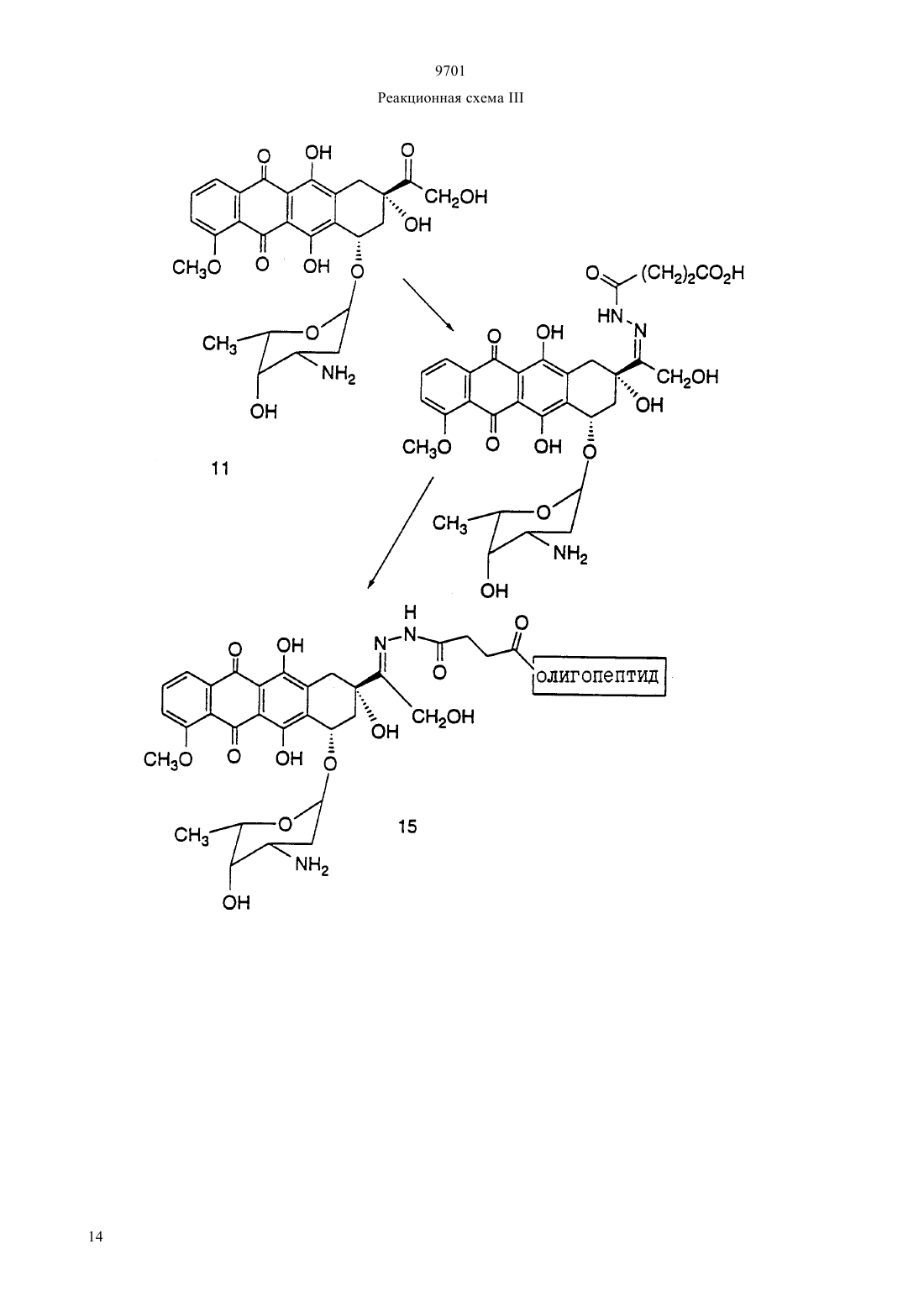
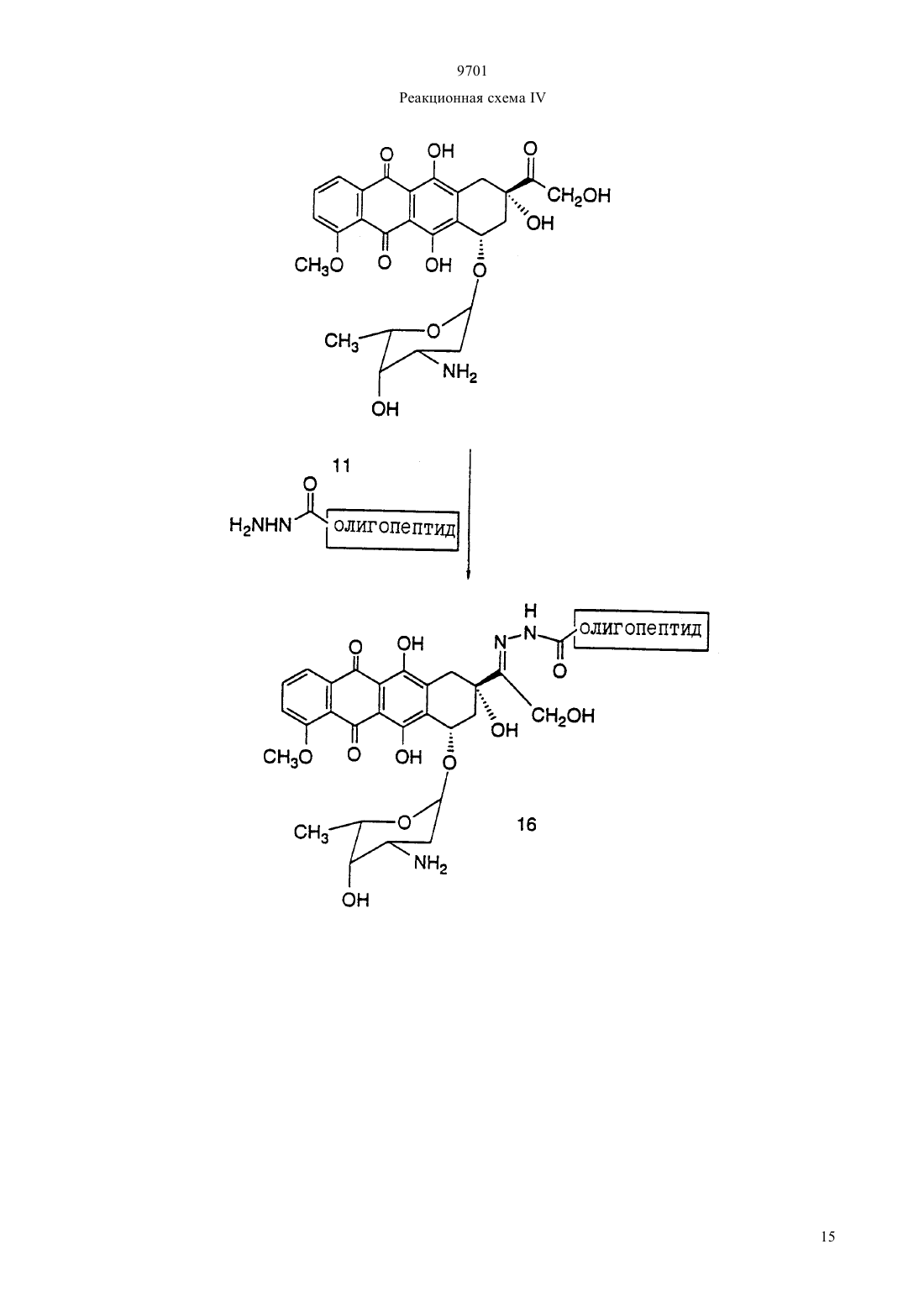
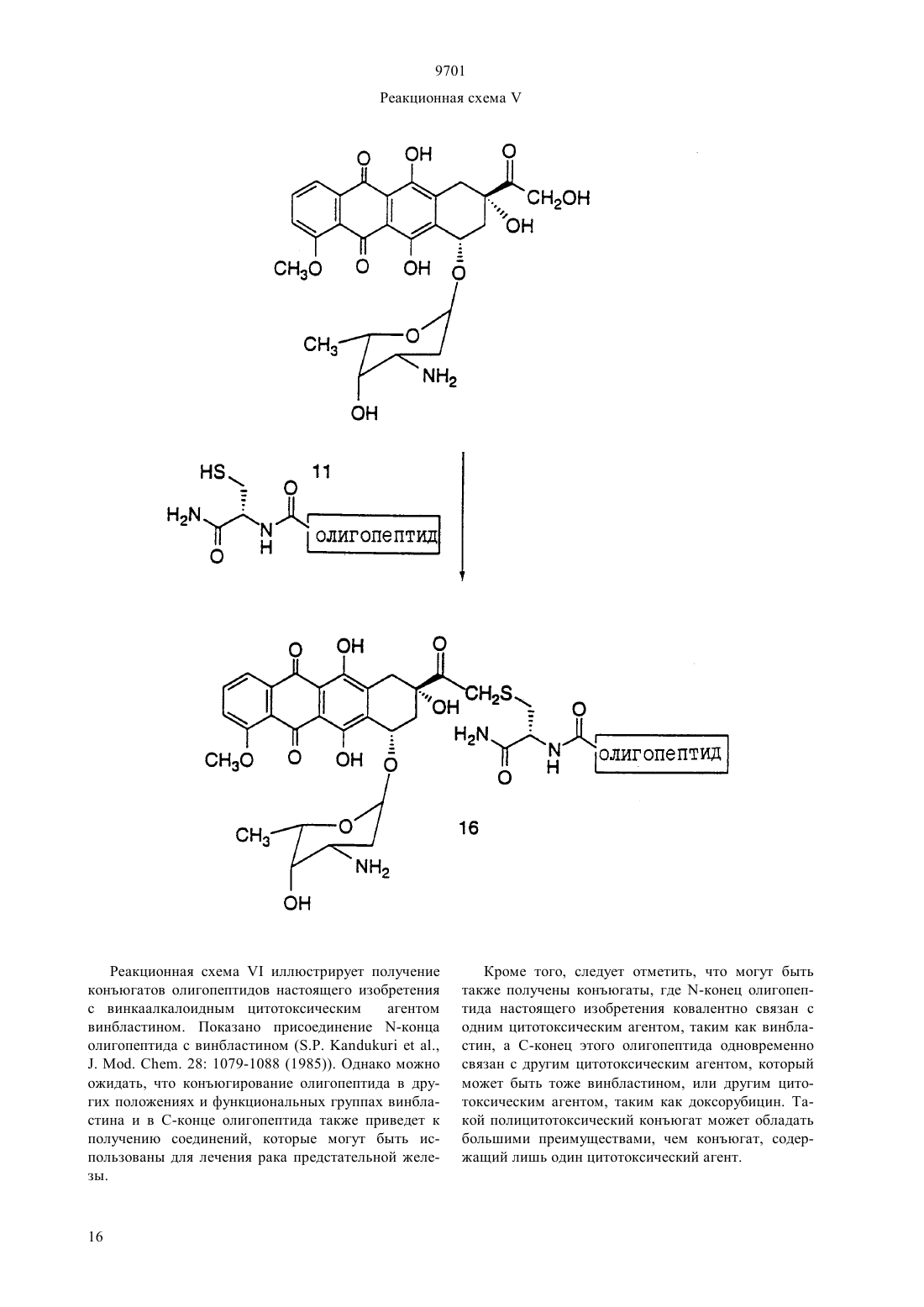
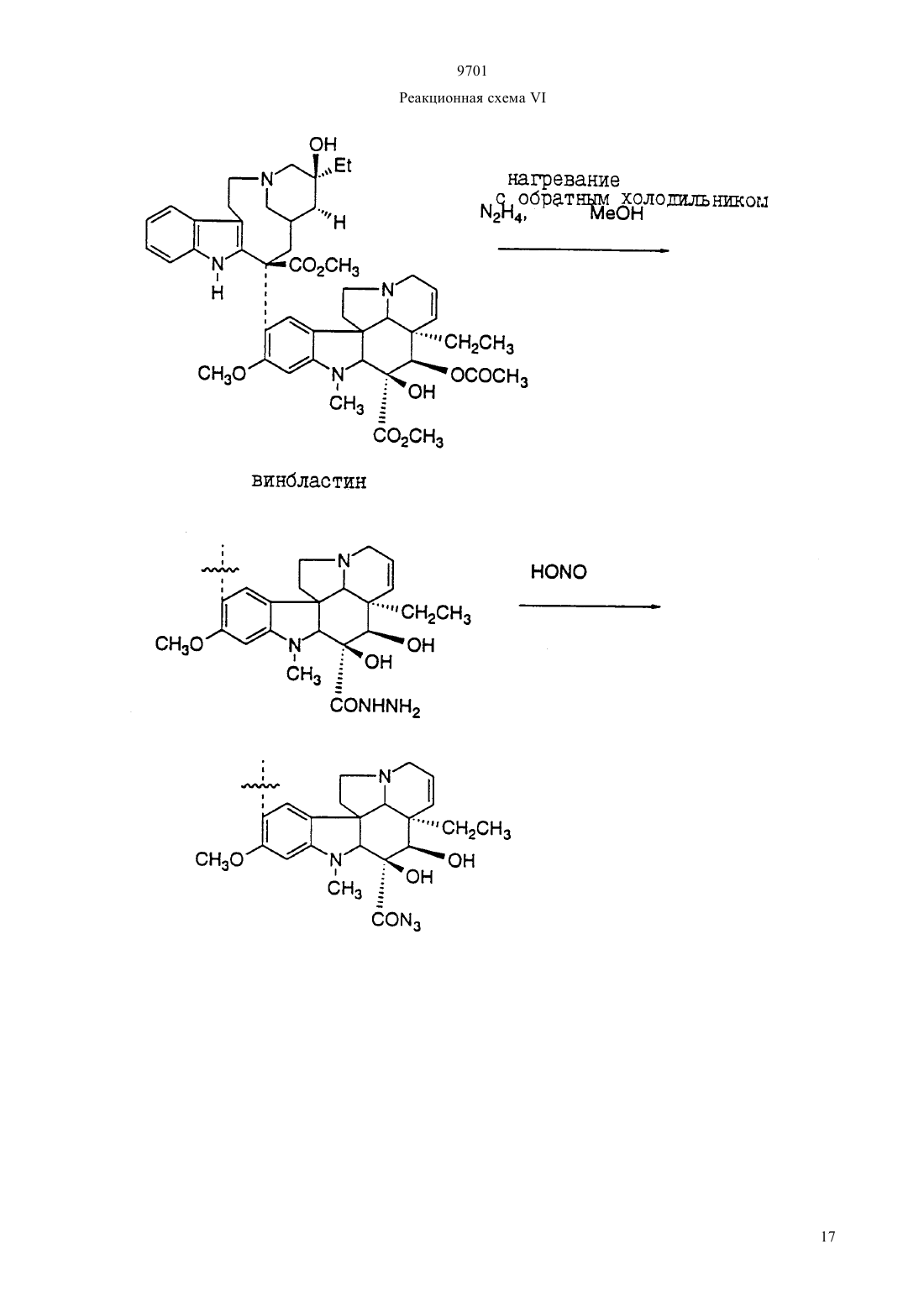
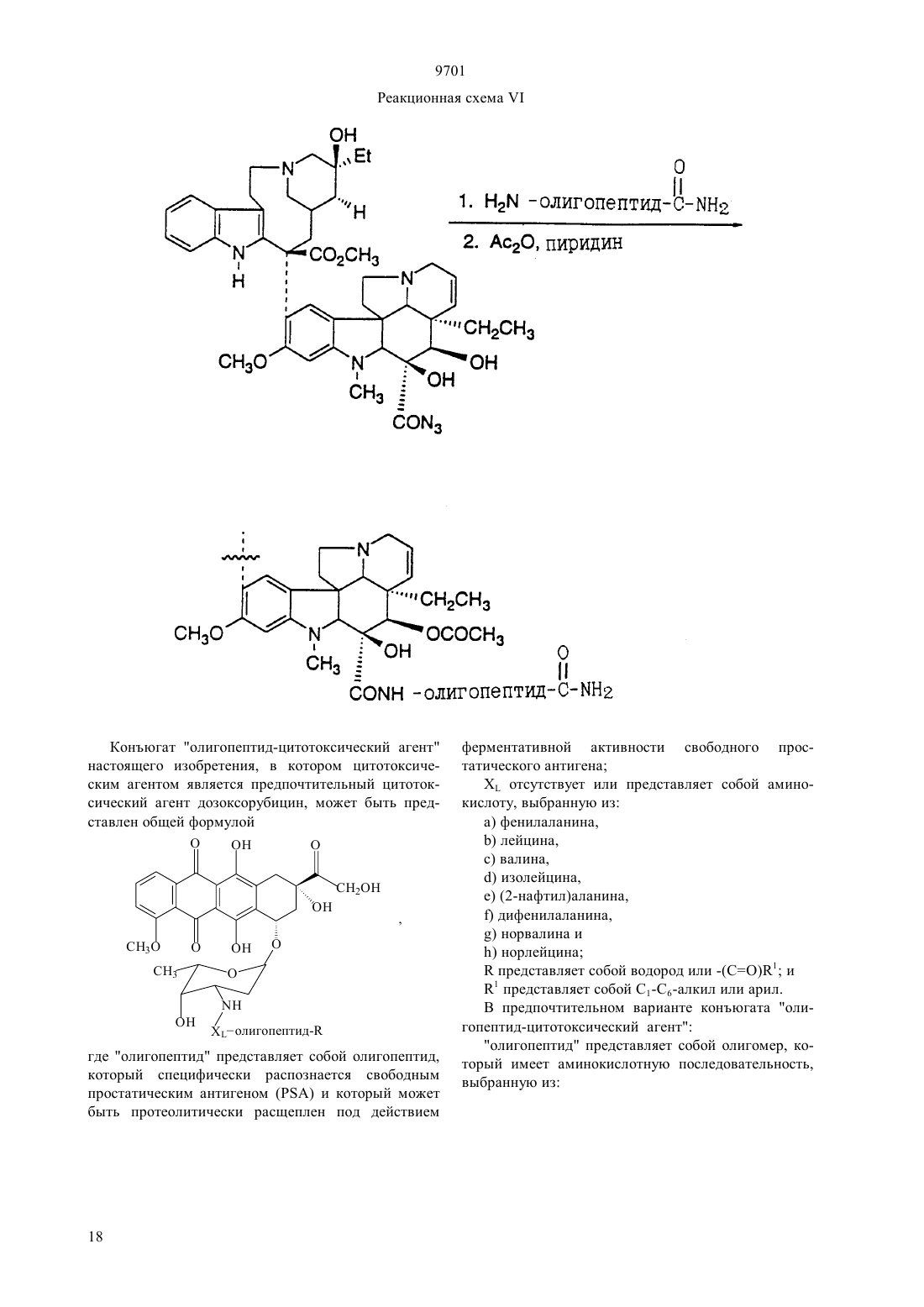
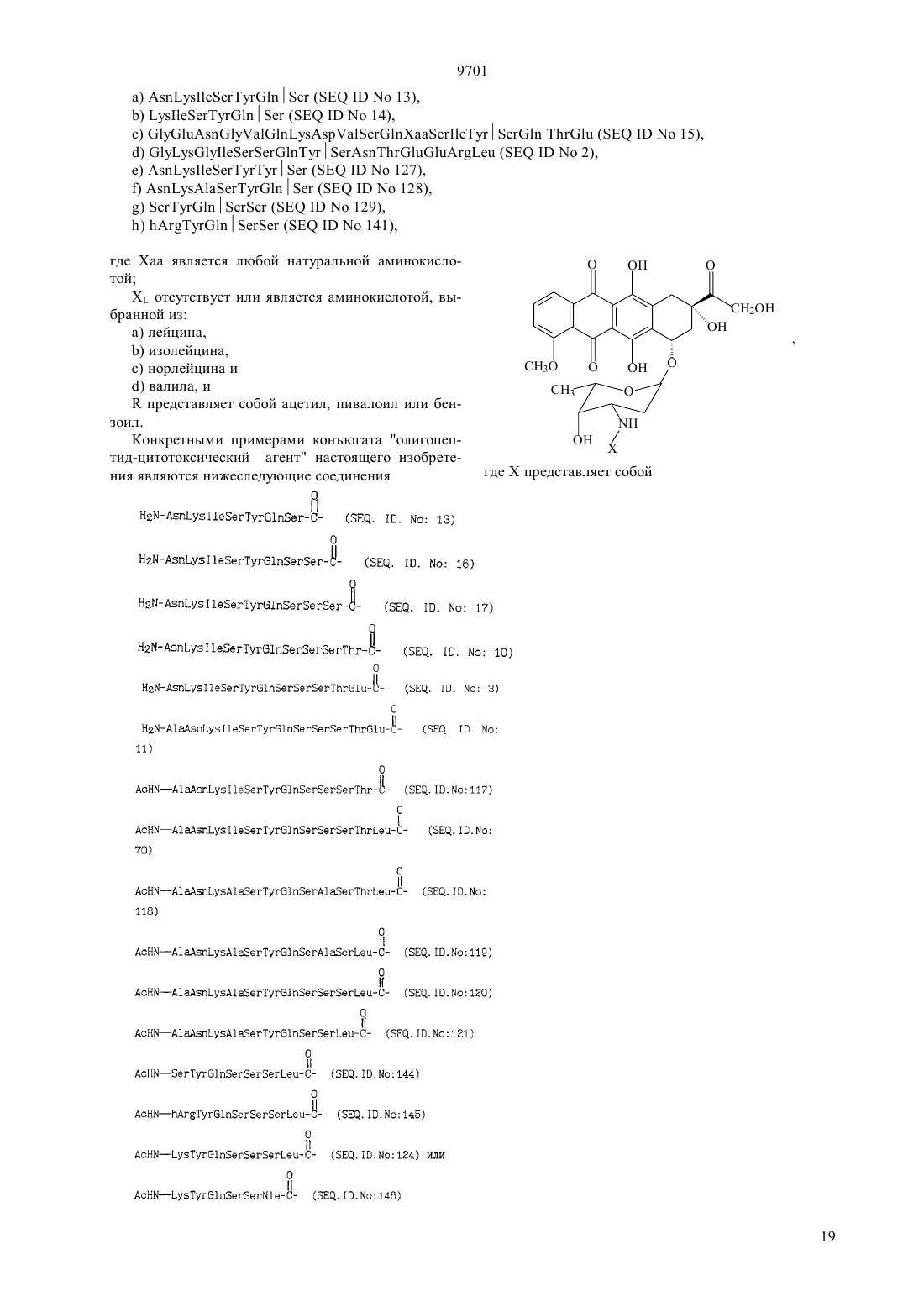
(51)7 61 38/04, 61 38/16, 07 7/00, 07 7/08, 61 35/00, 01 33/53, 01 33/68 ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(54) ОЛИГОПЕПТИД, КОНЪЮГАТ, ОБЛАДАЮЩИЙ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, КОТОРЫЙ ВКЛЮЧАЕТ НАЗВАННЫЙ ОЛИГОПЕПТИД(57) Изобретение относится к олигопептидам, которые имеют аминокислотную последовательность,распознаваемую и протеолитически расщепляемую свободным простатическим антигеном . Описаны также анализы, в которых указанные олигопептиды могут быть использованы для- и. Кроме того, раскрываются терапевтические агенты, содержащие конъюгаты указанных олигопептидов и известных цитотоксических агентов. 9701 Настоящая патентная заявка является частичным продолжением одновременно рассматриваемой заявки г.08/404833, поданной 15 марта 1995,которая, в свою очередь, является частичным продолжением одновременно рассматриваемой заявки г.08/267092, поданной 28 июня 1994. По предварительным данным, в 1994 г. в США число диагностированных случаев заболеваний раком предстательной железы у мужчин составляет 200000, при этом, смертность от этого заболевания может составить 38000 человек (, М.В.,72-81). Таким образом, рак предстательной железы является одним из наиболее часто диагностируемых раковых заболеваний (помимо рака кожи) у мужчин в США, и занимает второе место по смертности от рака (после рака легких). Простатический антигенпредставляет собой одноцепочечный гликопротеин в 33 кДа, который почти исключительно продуцируется эпителием предстательной железы человека и присутствует в сперме человека в количестве от 0,5 до 2,0 мг/мл(1981).6637 , , , , ,, (1990), . . 1441550 , , , , , ,. (1979), . . 17159). В этом гликопротеине имеется одна углеводная единица, которая присоединена к остатку аспарагина 45 и которая составляет 2-3 кДа от общей молекулярной массы.представляет собой протеазу с химотрипсинподобной специфичностью. . 194755-763). Было показано, чтоявляется ответственным, главным образом, за растворение гелевой структуры, образующейся при эякуляции, путем протеолиза основных (мажорных) белков, содержащихся в геле спермы, например,таких, как семеногелини семеногелин , и фибронектин (, Н. (1985). . . . 761899 ,., , ., , .,. (1987). . .. 39499). -опосредованный протеолиз гелеобразующих белков способствует образованию нескольких растворимых фрагментов семеногелинаи семеногелинаи растворимых фрагментов фибронектина с разжижением эякулята и высвобождением все более подвижных сперматозоидов (,Н., , С.В. (1984), . . . . . 44 447 , , (1987) . . 37 431). Кроме того, простатический антигенобладает способностью к протеолитическому расщеплению -3 (белка, связывающегося с инсулиноподобным фактором роста), что позволяет(инсулиноподобному фактору роста) специфически стимулировать рост -секретирующих клеток(., (1992) . . .., 75 10461053). Преобладающей молекулярной формой сывороточногоявляется комплекс, образованный 2 с альфа 1-антихимотрипсином и составляющий до 95 от всего обнаруживаемого сывороточного(нормальная ткань, доброкачественная гиперпластическая ткань и злокачественная ткань) высвобождает преимущественно зрелую ферментативно активную форму , поскольку такая форма необходима для образования комплекса с альфа 1 антихимотрипсином (, А.Е., , Т. . , . а 1. (1991),30 17231730 , , , , , ., .. (1990). . . . .87 3753-3757). Поэтому в микроокружении -секретирующих клеток предстательной железы , очевидно, процессируется и секретируется в своей зрелой ферментативно активной форме, не конъюгированной с какой-либо ингибирующей молекулой.также образует стабильные комплексы с альфа 2-макроглобулином, но, поскольку это приводит к инкапсуляциии полной потере -эпитопов, то смысл-образования такого комплекса пока не ясен. Свободная неконъюгированная формасоставляет минорную фракцию сывороточного. . 150 100-150 , ., , . . (1991) . . 37 1618-1625). Размер этой формы сывороточнойаналогичен размеру формы , присутствующей в семенной жидкости (, Н., , ., , . (1991). . 37 1618-1625), однако пока неизвестно,может ли свободная форма сывороточногобыть зимогеном внутренне гидролизованной неактивной формой зрелогоили , обладающим ферментативной активностью. Однако представляется маловероятным, что свободная форма сывороточногообладает ферментативной активностью, поскольку присутствующий в сыворотке молярный избыток обоих непрореагировавших альфа 1 антихимотрипсина и альфа 2-макроглобулина значительно превышает (в 100-1000) раз детектируемые сывороточные уровни свободной 33 кДа-формы. . 150 100-105 , ., , . . (1991). . . 37 1618-1625). Измерение уровнейв сыворотке может оказаться полезным при наблюдении за развитием аденокарциномы предстательной железы (,(1989). . . . 26 379-387 ,, (1989), . . 5 11-16 Наа, М., Н. (1989), . . . . 113 541-548), хотя, по имеющимся данным, повышение концентрациив сыворотке наблюдается также при доброкачественной гиперплазии предстательной железы и после хирургической операции на предстательной железе (, Н., , А., ,. (1991). . . 37 1617-1625). Кроме того, 9701 известно, что метастазы предстательной железы секретируют иммунореактивный , так как у пациентов с удаленной предстательной железой и с распространенными метастазами рака предстательной железы обнаруживаются высокие уровни сывороточного(, , , , ,, . . (1985). . .57 50-55). Поэтому цитотоксическое соединение, которое активируется посредством протеолитической активности, должно быть специфическим к клеткам предстательной железы, а также к -секретирующим метастазам предстательной железы. В соответствии с этим, задачей настоящего изобретения является получение новых олигопептидов,которые селективно и ферментативно расщепляются активным свободным простатическим антигеном. Другой задачей настоящего изобретения является разработка количественного анализа на ферментативную активностьс использованием новых олигопептидов. Следующей задачей настоящего изобретения является получение новой противораковой композиции, которая может быть использована для лечения рака предстательной железы и которая включает в себя новые олигопептиды, конъюгированные с цитотоксическим агентом. Еще одной задачей настоящего изобретения является обеспечение способа лечения рака предстательной железы, предусматривающего введение новой противораковой композиции. Было идентифицировано несколько сайтов расщепления, в которых семеногелинселективно протеолитически гидролизуется свободным . Описываются олигопептиды, имеющие аминокислотные последовательности, которые распознаются и протеолитически расщепляются свободным простатическим антигеном . Такие олигопептиды могут быть использованы в анализахидля определения протеазной активности свободного простатического антигена . Кроме того, указанные олигопептиды могут быть включены в терапевтические средства, которые содержат конъюгаты этих олигопептидов и известные цитотоксические агенты и которые могут быть использованы для лечения рака предстательной железы. Краткое описание фигур Фиг. 1 а и 1 первичная аминокислотная последовательность семеногелина . Показана первичная аминокислотная последовательность семеногелина(1). Показаны также сайты протеолитического расщепленияпростатическим антигеном (пронумерованные в соответствии с относительной аффинностью сайта по отношению к -гидролизу), при этом фрагменты белка пронумерованы начиная от амино-конца. Фиг. 2 ффинность в отношении гидролиза синтетических олигопептидов. Было получено гнездовое множество синтетических олигопептидов и эти олигопептиды были под вергнуты гидролизу ферментативно активным свободнымв течение различных промежутков времени. Полученные результаты представлены в табл. 2 (не определяли). Для обозначения аминокислот был использован однобуквенный код, где, , , , , , , , , , . Фиг. 3 а и 3 ффинность в отношении гидролиза синтетических олигопептидов. Получали синтетические олигопептиды, которые были подвергнуты гидролизу ферментативно активнымв течение четырех (4) часов. На фиг. приводится процент олигопептида, гидролизованного за этот период времени. Результаты представлены в табл. 4. Фиг. 4 данные о цитотоксичности нерасщепляемых конъюгатов олигопептид-доксорубицин. Данные, представленные на фигуре, иллюстрируют сравнительную цитотоксичность доксорубицина и конъюгата доксорубицина, ковалентно связанного с олигопептидом (соединение 12), который не содержит сайта протеолитического расщепления простатическим агентом. 50 для доксорубицина составляет 0,3 мкМ, тогда как доксорубицин, модифицированный ацетилированным олигопептидом,имеет более чем в 300 раз меньший 50. Этот конъюгат не имеет ВЭЖХ-обнаруживаемых примесей немодифицированного доксорубицина. Олигопептид, взятый отдельно, не обладает заметной цитотоксической активностью. Фиг. 5 аффинность-расщепления свободнымолигопептидов, конъюгированных с доксорубицином. Получали конъюгаты олигопептидов с доксорубицином и эти конъюгаты подвергали гидролизу ферментативно активным свободнымв течение четырех (4) часов. На рисунке приводится процент конъюгата, ферментативно расщепляемого в олигопептиде за этот период времени. Полученные результаты представлены в табл. 5. Фиг. 6 аффинность расщепления олигопептидов,конъюгированных с доксорубицином, в кондиционированной клетками среде. Конъюгаты олигопептидов с доксорубицином подвергали реакции в течение четырех (4) часов с культуральной средой, кондиционированной клетками(которые, как известно, секретируют свободный ) или клетками(которые не секретируют свободный ). На фигуре приводится процент конъюгата, гидролизованного в олигопептиде за этот период времени. Полученные результаты представлены в табл. 6. Фиг. 7 данные о цитотоксичности гидролизованных конъюгатов олигопептида и доксорубицина. Данные, представленные в табл. 7, иллюстрируют цитотоксичность (50) доксорубицина, ковалентно связанного с олигопептидом, содержащим сайт протеолитического расщепления свободным, направленную против раковой клеточной линии, которая, как известно, секретирует свободный 3. Для некоторых конъюгатов показано также,что они обладают цитотоксичностью против клеточной линии , которая не секретирует свободный . Подробное описание изобретения Настоящее изобретение относится к новым олигопептидам, которые специфически распознаются свободным простатическим антигеноми которые могут быть протеолитически гидролизованы благодаря ферментативной активности свободного простатического антигена. Такими олигопептидами являются олигомеры, имеющие аминокислотную последовательность, выбранную из следующих последовательностей)(13),)(14),с)(15),)(2),)(127),)(128),)(129),)(140),)(141) гдепредставляет собой гомоаргинин, а Хаа представляет собой любую натуральную аминокислоту. В одном из вариантов осуществления настоящего изобретения олигопептидами являются олигомеры,имеющие аминокислотную последовательность, выбранную из следующих последовательностей)(16),)(130),с)(7),)(18),)(19),)(4),)(5),)(131),)(132),)(133),)(134),)(142),)(143),)(135). В более предпочтительном варианте осуществления настоящего изобретения олигопептидами являются олигомеры, имеющие аминокислотную после довательность, выбранную из следующих последовательностей)(10),)(136),с)(3),)(11),)(4),)(137),)(138),)(139),)(94). В еще более предпочтительном варианте осуществления настоящего изобретения олигопептидами являются олигомеры, имеющие следующую выбранную аминокислотную последовательность Используемая в настоящем подробном описании фраза олигомеры, имеющие аминокислотную последовательность относится к олигомерам, состоящим примерно из 6-100 аминокислотных остатков, и содержащим в своей аминокислотной последовательности описанную специфическую аминокислотную последовательность, которая протеолитически 9701 расщепляется свободным . Так, например, олигомер(20) содержит аминокислотную последовательность(10), а поэтому входит в объем настоящего изобретения. При этом следует отметить, что такие олигомеры не являются семеногелиноми семеногелином . Кроме того, следует отметить, что настоящее изобретение относится также к олигомерам, где концевая аминокислота или С-концевая аминокислота, или обе концевые аминокислоты являются модифицированными. Такими модификациями являются, но не ограничиваются ими, ацилирование амино-группы у -конца и образование амидной группы для замены карбоксильной группы у Сконца. Добавление указанных групп может быть осуществлено в процессе твердофазного синтеза олигомера. Так, например, присоединение Сконцевой аминокислоты к твердофазной смоле может быть осуществлено с помощью амина, который приводит к образованию амидной группы после кислотного отщепления олигомера от смолы. Таким образом, используемый выше термин олигомеры,имеющие аминокислотную последовательность означает следующие соединения, но не ограничивается ими-амид (11),Ас- (70),амид (11),амид (70),амид (73),амид (74),амид (75),амид (78),амид (79),амид (81),амид (82),мид (84),амид (85),амид (16),амид (86),амид (87),амид (89),амид (92),амид (93),амид (94),амид (95),амид (96),амид (97),амид (98). Для каждого специалиста по пептидной химии совершенно очевидно, что некоторые аминокислоты в биологически активном олигопептиде могут быть заменены гомологичными, изостерными и/или изоэлектронными аминокислотами, но при этом биологическая активность такого модифицированного олигопептида аналогична биологической активности исходного олигопептида. Нижеследующий список аминокислотных замещений носит чисто иллюстративный, а не ограничивающий характер Исходная аминокислота, , ,Так, например, нижеследующие олигопептиды могут быть синтезированы способами, хорошо известными любому специалисту, и должны, как предполагается, протеолитически расщепляться свободным 9701(21)(22)(23)(24)(25)(26)(27)(28)(29)(30)(31)(32)(33)(35)(36)(37)(38)(39)(40)(41)(42)(43)(34)(44) Аналогично, нижеследующие олигопептиды могут быть синтезированы способами, хорошо известными любому специалисту, и должны, как предпо лагается, протеолитически расщепляться свободным(. .45),(. .47),(. .48),(. .49),(. .50),(. .51),(. .52),(. .53),(. .54),(. .55),(. .56), (. .57), (. .59), (. .60), (. .61), (. .62), (. .63), (. .64), (. .65), (. .58 и(. .46) и т. п. Символ , включенный в аминокислотную последовательность, указывает на точку протеолитического расщепления олигопептида свободным . Настоящее изобретение также относится к способу анализа на протеолитическую активность свободногов композиции. Этот способ является одним из важных аспектов настоящего изобретения и за 6 ключается в использовании аналитической системы,которая позволяет количественно определить содержание свободного , присутствующего в некоторых физиологических жидкостях и тканях. Кроме того, этот анализ не только позволяет контролировать выделение и очистку свободного , но также может быть положен в основу метода скрининга для 9701 идентификации ингибиторов протеолитической активности свободного . В общих чертах, этот метод заключается просто в определении способности композиции, которая, как предполагается, содержит ферментативно активный свободный , протеолитически расщеплять олигопептид. В основном, процедуру анализа осуществляют с использованием одного из олигонуклеотидов, описанных выше. Однако может оказаться предпочтительным разработать такой анализ, в котором олигопептид, содержащий сайт расщепления, был бы помечен меткой, например, радиоактивной меткой,присутствие которой как в нерасщепленном олигопептиде, так и в части олигопептида, оставшегося после расщепления и содержащего эту метку, можно было бы измерить. Кроме того, настоящее изобретение относится к способу идентификации соединений (называемых далее соединениями-кандидатами), которые ингибируют протеолитическую активность свободного . При этом предусматривается, что такой способ скрининга может быть с успехом использован для идентификации любого соединения-кандидата, которое является ингибитором, независимо от того,имеет или не имеет данное соединение-кандидат белковую или пептидиловую структуру. Таким образом, настоящее изобретение также относится к способу определения способности испытуемого соединения ингибировать протеолитическую активность свободногопричем указанный способ предусматривает а) осуществление реакции субстрата, имеющего аминокислотную последовательность, распознаваемую и селективно протеолитически расщепляемую свободным простатическим антигеном, со свободным простатическим антигеном в присутствии испытуемого соединения, и) установление факта расщепления субстрата,где на способность испытуемого соединения ингибировать протеолитическую активность указывает снижение уровня расщепления субстрата по сравнению с расщеплением субстрата в отсутствие испытуемого соединения. По своей разработке и осуществлению анализ в целях скрининга соединений-кандидатов является довольно простым, и во многом похож на вышеописанный анализ для определения протеолитической активности. Так, например, после получения относительно очищенного препарата свободного ,желательно просто смешать испытуемое соединение с протеолитическим препаратом, предпочтительно в таких условиях, при которыхможет осуществлять свою функцию расщепления, но в отсутствие ингибирующего соединения. Так, например, желательно включить в смесь определенное количество олигопептида, имеющего специфический сайт расщепления , такого, как олигопептиды, описанные выше. Таким образом, можно измерить способность испытуемого соединения снижать относительный уровень расщепления олигопептида в присутст вии испытуемого соединения. В соответствии с этим, для оценки относительной ингибирующей способности испытуемого соединения желательно измерить или как-нибудь иначе определить активность свободногов отсутствие добавляемого испытуемого соединения по сравнению с активностью в присутствии испытуемого соединения. Настоящее изобретение также относится к противораковым композициям, которые могут быть использованы для лечения рака предстательной железы. Такие композиции содержат олигопептиды настоящего изобретения, ковалентно связанные с цитотоксическим агентом либо непосредственно, либо с помощью химического линкера. Эта комбинация олигопептида и цитотоксического агента может быть определена как конъюгат. В идеальном случае,цитотоксическая активность цитотоксического агента является очень низкой или вообще отсутствует,если олигопептид, содержащий сайт протеолитического -расщепления, связан непосредственно или с помощью химического линкера с цитотоксическим агентом и является интактным. Кроме того, в идеальном случае цитотоксическая активность цитотоксического агента значительно возрастает или возвращается до уровня активности немодифицированного цитотоксического агента после протеолитического гидролиза связанного олигопептида в сайте расщепления. Наиболее предпочтительным, хотя и необязательным, вариантом осуществления настоящего изобретения является получение конъюгата,где олигопептид и химический линкер, если он присутствует, отделяются от цитотоксического агента под действием протеолитически активного свободногои либых других нативных протеолитических ферментов, присутствующих в окружающей ткани, высвобождая, тем самым, немолифицированный цитотоксический агент во внутреннюю среду организма в месте протеолитического расщепления. При этом следует отметить, что олигопептид настоящего изобретения, конъюгированный с цитотоксическим агентом, независимо от того, является ли он ковалентно связанным с этим агентом непосредственно или с помощью химического линкера, необязательно должен быть олигопептидом, наиболее распознаваемым и наиболее легко расщепляемым свободным . Так, например, выбор олигопептида для включения в противораковую композицию может быть осуществлен исходя из его селективности, протеолитической расщепляемости простатическим агентом, и цитотоксической активности конъюгата цитотоксического агента и протеолитического остатка (или, в идеальном случае, немодифицированного цитотоксического агента), являющейся следствием такого расщепления. Поскольку конъюгаты настоящего изобретения могут быть использованы для модификации данного биологического ответа, то цитотоксический агент не должен быть ограничен лишь классическими типами химических терапевтических агентов. Так, напри 7 9701 мер, цитотоксический агент может быть белком или полипептидом, обладающим нужной биологической активностью. Такими белками могут быть, например, токсин, такой, как абрин, рицин А, экзотоксин, или дифрерийный токсин белок, такой, как фактор некроза опухоли, альфа-интерферон,бета-интерферон, фактор роста нервной ткани,тромбоцитарный фактор роста, тканевый активатор плазминогена или модификаторы биологического ответа, такие как лимфокины, интерлейкин-1 (1), интерлейкин-2 (-2), интерлейкин-6 (-6),фактор, стимулирующий образование колоний гранулоцитов и макрофагов (-), фактор колониеобразования гранулоцитов (-) или другие факторы роста. Предпочтительными цитотоксическими агентами являются, в основном, алкилирующие агенты, антипролиферативные агенты, тубулин-связывающие агенты и т. п. Предпочтительными классами цитотоксических агентов являются, например, семейство антрациклиновых лекарственных средств, лекарственные средства, относящиеся к винка-соединениям митомицины блеомицины цитотоксические нуклеозиды семейство птеридиновых лекарственных средств диинены и подофиллотоксины. Особенно предпочтительными соединениями вышеуказанных классов являются, например, доксорубицин, карминомицин, даунорубицин, аминоптерин, метотрексат,метоптерин, дихлорометотрексат, митомицин С,порфиромицин, 5-фтороурацил, 6-меркаптопурин,цитозинарабинозид, подофиллотоксин или его производные, такие как этопозид или этопозидфосфат мелфалан, винбластин, винкристин, лейрозидин,виндезин, лейрозин и т. п. Другими подходящими цитотоксическими агентами являются эстрамустин,цисплатин и циклофосфамид. При этом каждый специалист может осуществить соответствующие химические модификации с образованием нужного соединения, которое является более пригодным для проведения реакций в целях получения конъюгатов настоящего изобретения. Особенно предпочтительной группой цитотоксических агентов настоящего изобретения являются лекарственные средства, имеющие следующие формулы. Группа метотрексатов формулы (1) 8(2) где 10 представляет собой водород или метил. Группа блеомицнов формулы (3)(1) где 12 представляет собой амино- или гидроксигруппу 7 представляет собой водород или метил 8 представляет собой водород, фтор, хлор, бром или йод 9 представляет собой гидрокси-группу или группу, образующую соль карбоновой кислоты. Группа митомицинов формулы (2) 8(7) где 13 представляет собой водород или метил 14 представляет собой метил или тиенил или их фосфатные соли. Лекарственные средства группы винкаалкалоидов формулы (8)(8) где 15 представляет собой Н, СН 3 или СНО, в случае, когда 17 и 18 взяты отдельно 18 представляет собой Н, причем, один из 16 и 17 является этилом, а другой является Н или ОН а в том случае, когда 17 и 18 взяты вместе с атомами углерода, с которыми они связаны, они образуют оксирановое кольцо, где 16 является этилом 19 представляет собой водород, (С 1-С 3 алкил)СО или хлор-замещенную группу (С 1-С 3 алкил)-СО. Дифторонуклеозиды формулы (9) 21(9) где 21 представляет собой основание, имеющее одну из формул где 22 представляет собой водород, метил, бром,фтор, хлор или иод 23 представляет собой -ОН или -2 24 представляет собой водород, бром, хлор или йод или антрациклиновые антибиотики формулы (10) 9701 Самыми предпочтительными лекарственными средствами являются антрациклиновые антибиотики формулы (10), описанные ранее. При этом следует отметить, что указанные структурные формулы описывают соединения, которые являются лекарственными средствами или производными лекарственных средств, имеющими различные родовые или тривиальные названия. В нижеприведенной табл. 1 представлены некоторые антрациклиновые лекарственные средства (и их родовые или тривиальные названия), которые являются особенно предпочтительными для использования в настоящем изобретении.(10) Соединение Даунорубицина) Доксорубицин) Детрорубицин Карминомицин Идарубицин Эпирубицин Эзорубицин ТНР а) альтернативным названием даунорубицина является дауномицин) альтернативным названием доксорубицина является адриамицин Из соединений, представленных в табл. 1, наиболее предпочтительным лекарственным средством является доксорубицин. Доксорубицин (обозначаемый также ) представляет собой антрациклин формулы (10), где 1 является -СН 2 ОН, 3 является -ОСН 3, 4 является -2, 5 является -ОН,6 является -Н. Олигопептиды, пептидные субъединицы и производные пептидов (также называемые пептидами) настоящего изобретения могут быть синтезированы из составляющих их аминокислот методом стандартного пептидного синтеза, предпочтительно методом твердофазного синтеза. Затем пептиды очищают с помощью обращенно-фазовой высокоразрешающей жидкостной хроматографии (ВЭЖХ). Стандартные методы пептидного синтеза описаны, например, в следующих работах 10,,,1984. Содержание этих работ вводится в настоящее описание посредством ссылки. Конъюгаты настоящего изобретения, содержащие олигопептид, имеющий сайт -расщепления и цитотоксический агент, могут быть аналогичным образом синтезированы методами, хорошо известными специалистам по клинической биохимии. Так,например, свободная аминная часть на цитотоксическом агенте может быть ковалентно присоединена к олигопептиду у карбоксильного конца, в результате 9701 чего образуется амид. Аналогичным образом, амидная связь может быть образована путем ковалентного связывания амино-группы олигопептида с карбоксильной группой цитотоксического агента. Для этих целей может быть использован такой реагент,как комбинация гексафторофосфата 2-(1 Н-бензотриазол-1-ил)-1,3,3-тетраметилурония (известного как ) и гидрата 1-гидроксибензотриазола (известного как НОВТ), дициклогексилкарбодиимида, -этил(3-диметиламинопропил)-карбодиимида , дифенилфосфорилазида , гексафторофосфата бензотриазол-1-ил-окси-трис-(диметиламино)фосфония (ВОР), и т. п. Кроме того, конъюгат настоящего изобретения может быть образован посредством непептидильной связи между сайтом расщепленияи цитотоксическим агентом. Так, например, цитотоксический агент может быть ковалентно присоединен к карбоксильному концу олигопептида посредством гидроксильной группы на цитотоксическом агенте, в результате чего образуется сложноэфирная связь. Для этих целей может быть использован такой реагент,как комбинацияи НОВТ, комбинация ВОР и имидазола, комбинацияи МАР и т. п. Карбоновая кислота может быть также активирована путем образования нитрофенилового эфира или т. п.,и подвергнута реакции в присутствии(1,8 диазабицикло 5,4,0 ундек-7-ен). Конъюгат настоящего изобретения может быть также образован путем присоединения олигопептида к цитотоксическому агенту посредством линкерной единицы. Такие линкерные единицы могут содержать, например, бикарбонилалкильный бирадикал, с помощью которого аминовую часть цитотоксического агента соединяют с линкерной единицей, в результате чего образуется амидная связь, а аминоконец олигопептида соединяют с другим концом линкерной единицы, в результате чего тоже образуется амидная связь. Могут быть также использованы другие линкерные единицы, которые являются стабильными в условиях физиологической среды при отсутствии свободного , но которые могут расщепляться после гидролиза в соответствующем сайте протеолитического расщепления под действием. Кроме того, могут быть использованы такие линкерные единицы, которые после -гидролиза в сайте протеолитического расщепления остаются связанными с цитотоксическим агентом, но при этом активность такого производного цитотоксического агента, образовавшегося после расщепления,заметно не уменьшается по сравнению с немодифицированным цитотоксическим агентом. При этом очевидно, что в процессе синтеза соединений настоящего изобретения может оказаться необходимым защитить или блокировать различные реактивные функциональные группы, присутствующие в исходных соединениях или в промежуточных соединениях, и в этом случае нужную реакцию осуществляют на других частях молекулы. После за вершения нужных реакций или по истечении необходимого периода времени такие группы обычно удаляют, например, путем гидролиза или гидрогенолиза. Указанные стадии блокирования и деблокирования являются традиционными процедурами в органической химии. Для выбора подходящих защитных групп, которые могут быть использованы при получении соединений настоящего изобретения,специалисты могут обратиться к работам, ,(1981). Примерами подходящих амино-защитных групп могут служить 1-10 алканоильные группы, такие как формил, ацетил, дихлорацетил, пропионил, гексаноил, 3,3-диэтилгексаноил, -хлорбутрил и т. п. 1-10 алкоксикарбонильные и 5-15 арилоксикарбонильные группы, такие как трет-бутоксикарбонил, бензилоксикарбонил, аллилоксикарбонил, 4 нитробензилоксикарбонил,флуоренилметилоксикарбонил и циннамоилоксикарбонил галоген-(С 1 С 10)-алкоксикарбонильная группа, такая как 2,2,2 трихлорэтоксикарбонил и 1-15 арилалкильные и алкенильные группы, такие как бензил, фенетил,аллил, тритил и т. п. Другими обычно используемыми амино-защитными группами являются группы в форме енаминов, полученных с помощью -кетоэфиров, таких как метил- или этилацетоацетат. Подходящими карбокси-защитными группами могут быть, например, 1-10 алкильные группы,такие как метил, трет-бутил, децил галоген-1-10 алкильные группы, такие как 2,2,2-трихлорэтил и 2 йодэтил 5-15 арилалкильные группы, такие как бензил, 4-метоксибензил, 4-нитробензил, трифенилметил, дифенилметил 1-10 алканоилоксиметильные группы, такие как ацетоксиметил, пропионоксиметил и т. п. и такие группы, как фенацил, 4 галогенфенацил, аллил, диметилаллил, три-(С 1 С 3 алкил), силил, например, триметилсилил, -птолуолсулъфонилэтил, -п-нитрофенил-тиоэтил, 2,4,6-триметилбензил, -метилтиоэтил, фталимидометил, 2,4-динитро-фенилсульфенил, 2-нитробензгидрил и родственные группы. Аналогично, подходящими гидрокси-защитными группами могут быть, например, формильная группа, хлорацетильная группа, бензильная группа,бензгидрильная группа, тритильная группа, 4-нитробензильная группа, триметилсилильная группа, фенацильная группа, трет-бутильная группа, метоксиметильная группа, тетрагидропиранильная группа и т. п. Предпочтительный вариант получения олигопептида, конъюгированного с антрациклиновым антибиотиком дозоксорубицином, представлен в нижеследующих реакционных схемах, где проиллюстрирован синтез конъюгатов настоящего изобретения. Реакционная схемаиллюстрирует получение конъюгатов олигопептидов настоящего изобретения с винкаалкалоидным цитотоксическим агентом винбластином. Показано присоединение -конца олигопептида с винбластином (.,. . . 28 1079-1088 (1985. Однако можно ожидать, что конъюгирование олигопептида в других положениях и функциональных группах винбластина и в С-конце олигопептида также приведет к получению соединений, которые могут быть использованы для лечения рака предстательной железы. Кроме того, следует отметить, что могут быть также получены конъюгаты, где -конец олигопептида настоящего изобретения ковалентно связан с одним цитотоксическим агентом, таким как винбластин, а С-конец этого олигопептида одновременно связан с другим цитотоксическим агентом, который может быть тоже винбластином, или другим цитотоксическим агентом, таким как доксорубицин. Такой полицитотоксический конъюгат может обладать большими преимуществами, чем конъюгат, содержащий лишь один цитотоксический агент. Конъюгат олигопептид-цитотоксический агент настоящего изобретения, в котором цитотоксическим агентом является предпочтительный цитотоксический агент дозоксорубицин, может быть представлен общей формулой где олигопептид представляет собой олигопептид,который специфически распознается свободным простатическим антигеноми который может быть протеолитически расщеплен под действием ферментативной активности свободного простатического антигенаотсутствует или представляет собой аминокислоту, выбранную из а) фенилаланина,) лейцина,с) валина,) изолейцина,) (2-нафтил)аланина,) дифенилаланина,) норвалина и) норлейцинапредставляет собой водород или -1 и 1 представляет собой 1-С 6-алкил или арил. В предпочтительном варианте конъюгата олигопептид-цитотоксический агент олигопептид представляет собой олигомер, который имеет аминокислотную последовательность,выбранную из)(13),)(14),с)(15),)(2),)(127),)(128),)(129),)(141),гдеявляется любой натуральной аминокислотойотсутствует или является аминокислотой, выбранной из а) лейцина,) изолейцина,с) норлейцина и) валила, ипредставляет собой ацетил, пивалоил или бензоил. Конкретными примерами конъюгата олигопептид-цитотоксический агент настоящего изобретения являются нижеследующие соединения 9701 Как хорошо известно специалистам и как очевидно из настоящего изобретения, пептидиловые терапевтические агенты, такие как конъюгаты олигопептид-цитотоксический агент настоящего изобретения предпочтительно имеют концевые аминогруппы любого олигопептидного заместителя, которые защищены соответствующей защитной группой,такой как ацетил, бензоил, пивалоил и т. п. Такая защита концевых амино-групп снижает или устраняет возможность ферментативной деградации указанных пептидиловых терапевтических агентов под действием экзогенных аминопептидаз, присутствующих в плазме крови теплокровных животных. В соответствии с настоящим изобретением,конъюгаты олигопептида и цитотоксического агента вводят пациенту в виде фармацевтической композиции, содержащей конъюгат формулы (1) и фармацевтически приемлемый носитель, наполнитель или разбавитель. Используемый в настоящем описании термин фармацевтически приемлемый относится к тем агентам, которые могут быть использованы при лечении или диагностики теплокровных животных,например, человека, лошади, свиньи, коровы, мыши, собаки, кошки или других млекопитающих, а также птиц или других теплокровных животных. При этом, предпочтительным является парентеральный способ введения, а в частности, внутривенное,внутримышечное, подкожное, внутрибрюшинное или внутрилимфатическое введение. Указанные препараты могут быть получены с использованием носителей, разбавителей или наполнителей, которые обычно используются в этих целях. В этой связи,см., например,,16 ., 1980,,. Эти композиции могут включать в себя белки, например, сывороточные белки, такие как альбумин сыворотки человека буферы или забуферивающие соединения, такие как фосфаты, другие соли или электролиты и т. п. Подходящими разбавителями являются, например, стерильная вода, изотонический раствор, водный раствор декстрозы,многоатомный спирт или смеси таких спиртов, например, глицерин, пропиленгликоль, полиэтиленгликоль и т. п. Указанные композиции могут содержать консерванты, такие как фенетиловый спирт,метил- и пропилпарабены, тимеросал и т. п. Если необходимо, то в композицию может быть включено от около 0,05 до около 0,20 масс. антиоксиданта,такого как метасульфит натрия или бисульфит натрия. Композицию для внутривенного введения изготавливают предпочтительно так, чтобы количество вводимого пациенту конъюгата составляло от около 0,01 до около 1 г. Предпочтительное количество вводимого конъюгата составляет в пределах от около 0,2 до около 1 г. Конъюгаты настоящего изобретения могут быть эффективными в широком диапазоне доз в зависимости от таких факторов, как тяжесть заболевания, на которое направлено лечение,модифицируемый биологический эффект, который 20 желательно достигнуть, способ введения конъюгата,возраст, вес и состояние пациента, а также другие факторы, которые должны быть учтены лечащим врачом. Таким образом, количество конъюгата, необходимое для введения данному пациенту, должно быть определено индивидуально для каждого пациента. При этом следует отметить, что хотя в примерах,приведенных ниже, описаны конкретные реагенты и реакционные условия, однако, очевидно, что существо и объем настоящего изобретения также охватывают и различные их модификации. Поэтому нижеследующие процедуры и примеры носят лишь иллюстративный характер и не должны рассматриваться как некое ограничение изобретения. ПРИМЕРЫ Пример 1 Идентификация сайта РА-опосредованного расщепления семеногелина Разжижение семенного геля соответствует протеолитической фрагментации семеногелина (, Н. С.В., (1984) . . . . . 44,447-452). Полагают, что протеолитическая фрагментация обусловлена, главным образом, активностью простатического антигена (, Н., (1985) . .. 76, 1899-1903). Используя опубликованную последовательность семеногелина(, Н., , , , ., (1989. . . 264, 1894-1900) (рис. 1), мы сконструировали праймеры (-полимеразная цепная реакция) для клонирования кДНК семеногелина из коммерчески доступной кДНК-библиотеки, кодирующей белки предстательной железы (,, СА.). Очищенную кДНК семеногелина встраивали в бактериальный экспрессирующий вектор рТАС (, , , . ., , , , ., , ., , (1987)/ 5, 960-965). кДНК семеногелина конструировали таким образом, что эпитоп тубулина находился у карбоксильного конца белка семеногелина. Семеногелин, экспрессированный с помощью бактериального вектора, очищали на колонке с антителом против тубулина. Очищенный белок семеногелинсмешивали с простатическим антигеном(изготовленным промышленным путем (,, , в молярном отношении 100/1 (семеногелин 1/) в 12 мМ Трис, рН 8,0, 25 мМ , 0,5 мМ 2, а затем инкубировали в течение различных промежутков времени. Гидролизат фракционировали с помощью электрофореза в полиакриламидном геле и переносили путем электрофореза на фильтровальную бумагу Ро ( , .,,.) в буфере(, ., (1987) . .. 252, 10035-10038). Фильтровальную бумагуокрашивали кумасси синим для идентификации новых -продуцированных фрагментов семеногелина . Новые фрагменты вырезали из фильтра скальпелем и определяли их последовательности. После идентификации протеолитических 9701 фрагментов посредством гидролиза в различные периоды времени проводили реакцию гидролиза в течение 10 минут. Затем определяли относительную аффинностьдля 5 потенциальных сайтов расщепления в последовательности семеногелина , а именно сайт 349/350 сайт 375/376 сайт 289/ 290 сайт 315/316 сайт 159/160. Относительные аффинности были получены исходя из интенсивности окраски кумасси синим каждого продуцированного пептидного фрагмента. Эти интенсивности имели приблизительные отношения 310,60,3. Пример 2 Получение олигопептидов, содержащих сайт РА-опосредованного расщепления Олигопептиды получали путем твердофазного синтеза, где введение аминокислот осуществляли по схеме двойного присоединения на автоматическом пептидном синтезаторемодели 430 А. Деблокирование и отделение олигопептида от полимерного носителя осуществляли путем обработки жидкой фтористоводородной кислотой. Олигопептиды очищали с помощью препаративной жидкостной хроматографии высокого давления на обращенно-фазовой колонке с двуокисью кремния 18 с использованием градиента водной 0,1 трифторуксусной кислоты/ацетонитрила. Идентичность и гомогенность олигопептидов были подтверждены с помощью анализа аминокислотного состава жидкостной хроматографией высокого давления и массспектрометрического анализа путем бомбардировки быстрыми атомами. Олигопептиды, полученные этим методом, представлены на фиг. 2. Пример 3 Оценка распознавания олигопептидов свободным Олигопептиды, полученные как описано в примере 2, отдельно растворяли в буфере для гидролиза (12 мМ трис (гидроксиметил)аминометан,рН 8,0. 25 мМ , 0,5 мМ 2) и полученный раствор добавляли кв молярном отношении 1001. Реакцию прекращали через различные промежутки времени путем добавления трифторуксусной кислотыдо конечного объема 1(объем/объем). Погашенную реакцию анализировали с помощью ЖХВД на обращенно-фазовой колонке 18 с использованием градиента 0,1/ацетонитрила. Результаты оценки представлены на фиг. 2. Другие олигопептиды, полученные,как описано в примере 2, были проанализированы тем же способом, за исключением того, что реакцию гасили через 4 часа. Результаты оценки показаны на фиг. 3. Удаление аспарагинового остатка из аминоконца олигопептида приводит к значительному ослаблению -опосредованного гидролиза пептида,а присутствие остатка глутаминовой кислоты в карбоксильном конце пептида, очевидно, не играет решающей роли в распознавании простатическим антигеном. Пример 4 Получение нерасщепляемых конъюгатов олигопептида и доксорубицина Производные доксорубицина, показанные в табл. 3, были получены в соответствии со следующей общей реакцией. К смеси доксорубицинаи соответствующего пептида (полученного путем твердофазного синтеза или закупленного в готовом виде ( в ДМСО добавлялии НОВТ вместе с диизопропилэтиламином и реакционную смесь размешивали в течение ночи. Затем неочищенную реакционную смесь очищали с помощью препаративной ВЭЖХ на обращенно-фазовой колонке с С-18, используя градиент 0,1 трифторуксусной кислоты 9701 Пример 5-анализ цитотоксичности пептидиловых производных доксорубицина Цитотоксичности нерасщепляемых конъюгатов олигопептида и доксорубицина (полученных, как описано в примере 4) против линии клеток, которые,как известно, подвергаются цитолизу под действием немодифицированного доксорубицина, оценивали посредством анализа с использованием аламарового синего. Для этого клеточные культуры клеток опухоли предстательной железы , которые представляют собой метастатические клетки аденокарциомы предстательной железы, выделенные из пункционной биопсии лимфатического узла (.Американская коллекция типовых культур,АТСС 1740), или клетокв 96-луночных планшетах разводили средой, содержащей различные концентрации данного конъюгата (конечный объем лунки планшета составляет 200 мкл). Затем клетки инкубировали в течение 3 дней при 37 С,после чего в лунку добавляли 20 мкл аламарового синего. После этого клетки снова инкубировали и аналитические планшеты прочитывали на ридере Е-310 при двух длинах волн 570 и 600 нм через 4 и 7 часов после добавления аламарового синего. Затем вычисляли относительный процент жизнеспособности клеток при различных концентрациях испытуемых конъюгатов по сравнению с контрольными культурами (в отсутствие конъюгата). Оценивали также цитотоксичности немодифицированного дозоксорубицина и немодифицированного олигопептида. На фиг. 3 представлены данные цитотоксичности для характерного соединения (оединения 12). Пример 6 Оценка ферментативной активности простатического антигена, происходящего из клетокФерментативная активность была продемонстрирована путем инкубирования кондиционированной клеткамибессывороточной среды (примерно 200-кратно концентрированной) с рекомбинантным белком семеногелином . Затем приблизительно 0,5 мкг иммунореактивногов концентрированной кондиционированной среде (определенной с помощью( Е смешивали приблизительно с 3 мкг рекомбинантного семеногелинаи инкубировали в течение 4 часов при 37 С. По окончании инкубирования гидролизованную смесь анализировали с помощью Вестернблот-анализа. Результаты показали, что очищенныйиз спермы ииз -кондиционированной среды давали идентичные протеолитические карты рекомбинантного белка семеногелина . Таким образом клеткипродуцируют ферментативно активный . Клеткиявляются онкогенными у голых (бестимусных) мышей и продуцируют детектируемые уровни циркулирующего . Пример 7 Получение расщепляемых конъюгатов олигопептида-доксорубицина 22, ковалентно связан с амином углеводной части доксорубицина, были получены в соответствии со следующей общей реакцией к смеси дозоксорубицинаи соответствующего пептида (полученного путем твердофазного синтеза, как описано в примере 2) в ДМСО добавлялии НОВТ вместе с диизопропилэтиламином и реакционную смесь перемешивали в течение ночи. Неочищенную реакционную смесь очищали с помощью препаративной ВЭЖХ на обращенно-фазовой колонке с С-18, используя градиент 0,1 трифторуксусной кислоты в ацетонитриле/0,1 в воде. В случае,если на пептиде присутствовали реакционноспособные амино-группы, то эти функциональные группы обычно блокировали флуоренилметилоксикарбонильной защитной группой, которую затем удаляли путем обработки вторичным амином, таким как пиперидин и т. п., а затем конъюгировали с доксорубицином. Конъюгаты настоящего изобретения имеют структуру общей формулы и могут быть обозначены как Ас-пептид-ОХ (3). Конъюгаты, полученные этим способом, представлены на фиг. 5 в табл. 5. Пример 8 Оценка распознавания конъюгатов олигопептид-доксорубицин свободнымКонъюгаты, полученные как описано в примере 7, отдельно растворяли в буфере для -гидролиза(12 мМ трис(гидроксиметил)аминометан, рН 8,0 0,25 мМ , 0,5 мМ 2), и полученный раствор добавляли кв молярном отношении 1001. Реакцию гасили через различные промежутки времени путем добавления трифторуксусной кислотыдо конечной концентрации 1(объем/объем). После гашения реакции реакционную смесь анализировали с помощью ВЭЖХ на обращенно-фазовой колонке с -18 с использованием градиента водной 0,1/ацетонитрила. Результаты оценки показаны на фиг. 5 в табл. 5. Пример 9 Оценка расщепления конъюгатов олигопептиддоксорубицин в кондиционированной клетками среде Кондиционированные клетками бессывороточные среды МЕМ (не содержащие фенолового крас 9701 ного) собирали через 3 дня после их добавления либо к клеточной линии , либо к клеточной линии(полученных, как описало в . ,146 915-919 (1991. Эти среды 20-кратно концентрировали с использованием концентратора с молекулярно-массовой отсечкой 10000. -кондиционированная среда содержала свободный -белок в средней концентрации приблизительно 100 нг/мл, как было определено с помощью набора для иммунодетекции -. При этом в кондиционированной клеткамисреде свободного простатического антигена обнаружено не было. 100 мкл-порции концентрированной кондиционированной среды смешивали с 35 мкг конъюгата олигопептида-доксорубицина, полученного как описано в примере 7, и смесь инкубировали при 37 С в течение периодов времени 0, 4 и 24 часа. Затем реакции прекращали путем добавления 2 (до конечной концентрации 0,01 М) и анализировали с помощью ВЭЖХ на обращенно-фазовой колонке с 18 и с использованием градиента водной 1/ацетонитрила в целях определения процента гидролизованного конъюгата пептида-цитотоксического агента. Результаты оценки представлены на фиг. 6 в табл. 6. Пример 10-анализ цитотоксичности пептидиловых производных доксорубицина Цитотоксичность расщепляемых конъюгатов олигопептида-доксорубицина (полученных как описано в примере 7) против линии клеток, которые,как известно, подвержены цитолизу под действием немодифицированного доксорубицина, оценивали с помощью анализа с использованием аламарового синего, как описано в примере 5. Для этого клеточные культуры опухолевых клеток предстательной железыили клетокв 96-луночных планшетах разводили средой, содержащей различные концентрации данного конъюгата (конечный объем лунки планшета составлял 200 мкл). Затем клетки инкубировали в течение 3 дней при 37 С, и в аналитическую лунку добавляли 20 мкл аламарового синего. После этого клетки снова инкубировали и аналитические планшеты прочитывали на ридере -310 при двух длинах волн 570 и 600 нм через 4 и 7 часов после добавления аламарового синего. Затем вычисляли относительный процент жизнеспособности клеток при различных концентрациях испытуемых конъюгатов по сравнению с контрольными культурами (в отсутствие конъюгата). В этом же самом анализе оценивали также цитотоксичность конъюгатов по сравнению с цитотоксичностью немодифицированного доксорубицина и немодифицированного олигопептида. Результаты анализа представлены на фиг. 7 в табл. 7. Список последовательностей Общая информация Название изобретения новые пептиды(А) Тип носителя гибкий диск(В) Компьютер РС совместимый с Телекоммуникационные данные Телефон (908)594-3903 Телефакс (908)594-4720 Данные последовательности 1 Характеристики последовательности Длина 462 аминокислоты Тип аминокислотная Цепочечность одноцепочечная Топология линейная Тип молекулы пептид Гипотетичность нет Антисмысловая нет Тип фрагмента внутренний Описание последовательности 1 Тип аминокислотная Цепочечность одноцепочечная Топология линейная Характеристики последовательности Длина 17 аминокислот Тип аминокислотная Цепочечность одноцепочечная Топология линейная
МПК / Метки
МПК: G12N 15/10, G01N 33/53, G01N 33/569
Метки: обладающий, противораковой, коньюгат, активностью, названный, включает, олигопептид
Код ссылки
<a href="https://kz.patents.su/30-9701-oligopeptid-konyugat-obladayushhijj-protivorakovojj-aktivnostyu-kotoryjj-vklyuchaet-nazvannyjj-oligopeptid.html" rel="bookmark" title="База патентов Казахстана">Олигопептид, конъюгат, обладающий противораковой активностью, который включает названный олигопептид</a>
Предыдущий патент: Способ определения функционального состояния почек при их хронических заболеваниях
Следующий патент: Персональный компьютер
Случайный патент: Устройство для снижения динамических нагрузок прокатных станов