Выделенная нуклеиновая кислота гена гелиантинина, химерный ген растений, вектор трансформации растений, клетка растений, способ получения растения, резистентного к гербициду
Номер патента: 8474
Опубликовано: 14.01.2000
Авторы: Мишель Лебрюн, Молли Бог, Терри Томас, Жорж Фрейссине
Формула / Реферат
Гелиантинин является 11S белком "хранения" семян подсолнечника.
Настоящее изобретение направлено на 5'-регуляторную область гена гелиантинина. В частности, настоящее изобретение направлено на специфические цис-регуляторные элементы регуляторной области, которая направляет тканеспецифичную, зависимую от времени и зависимую от абсцизовой кислоты экспрессию.
Настоящее изобретение обеспечивает химерные гены, содержащие цис-регуляторные элементы, связанные с кодирующей последовательностью гетерологичного гена для осуществления контроля экспрессии этих генов. Химерные гены согласно изобретению используют для получения трансгенных растений с резистентностью к гербицидам и улучшенным липидным составом.
Текст
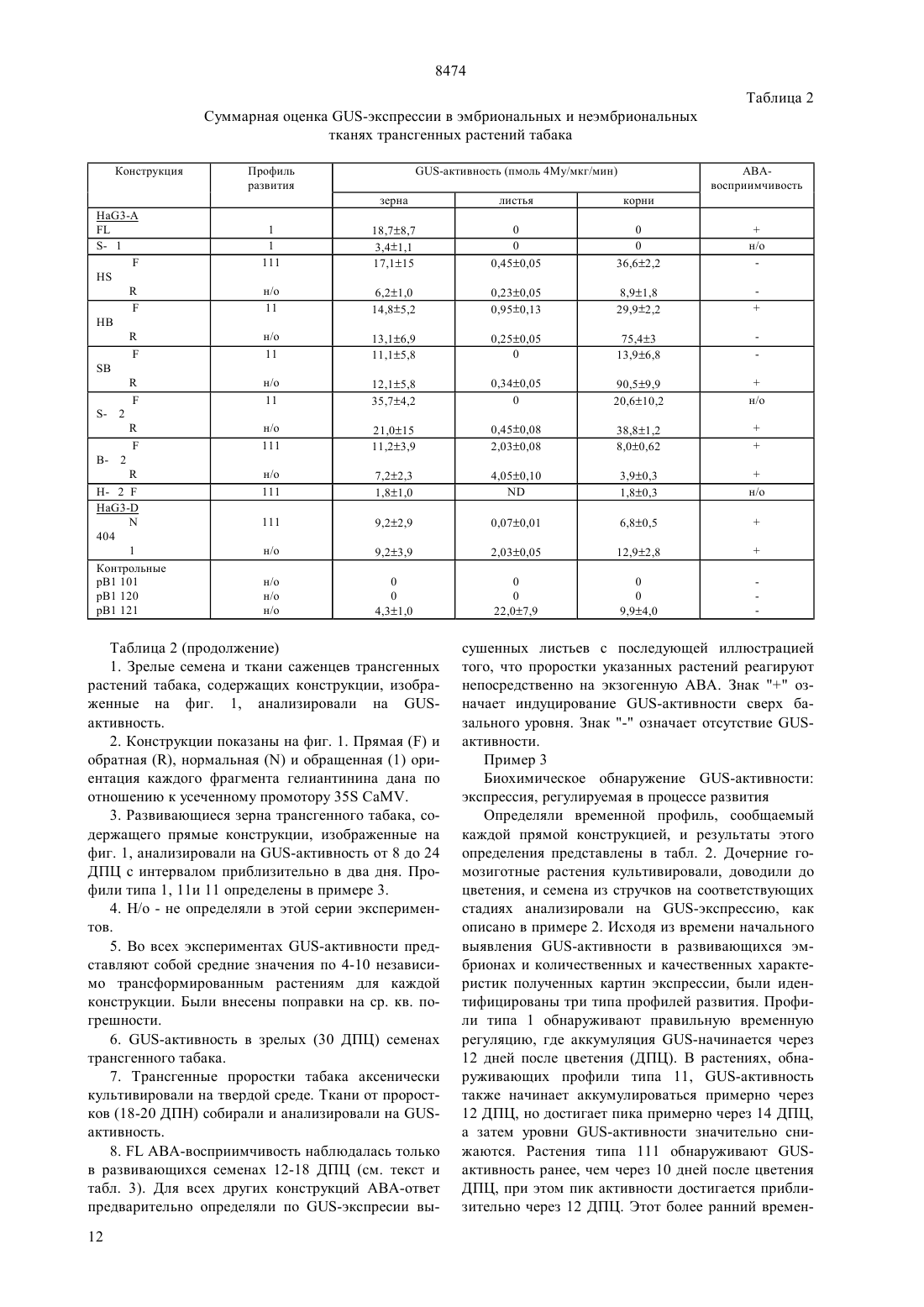
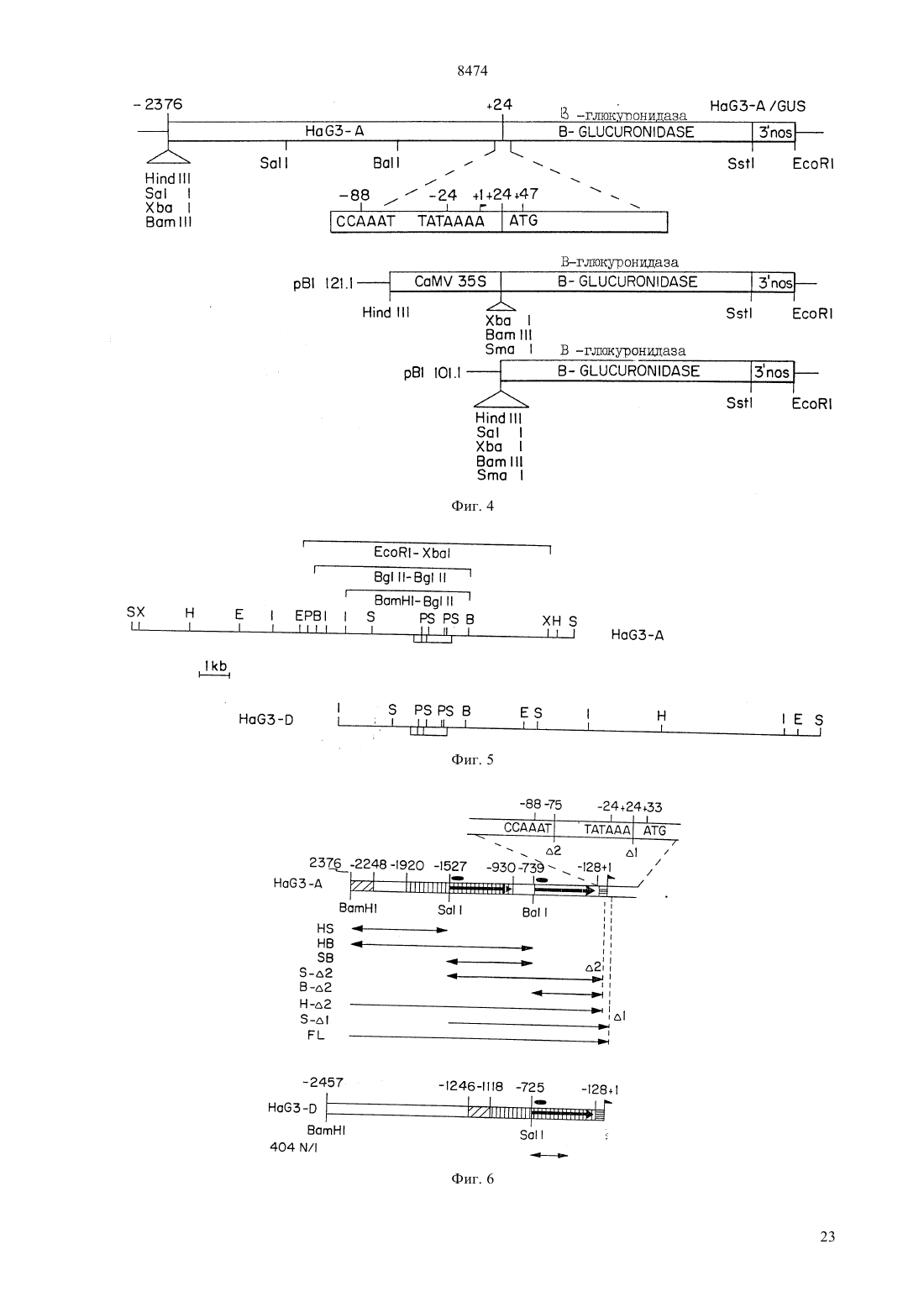
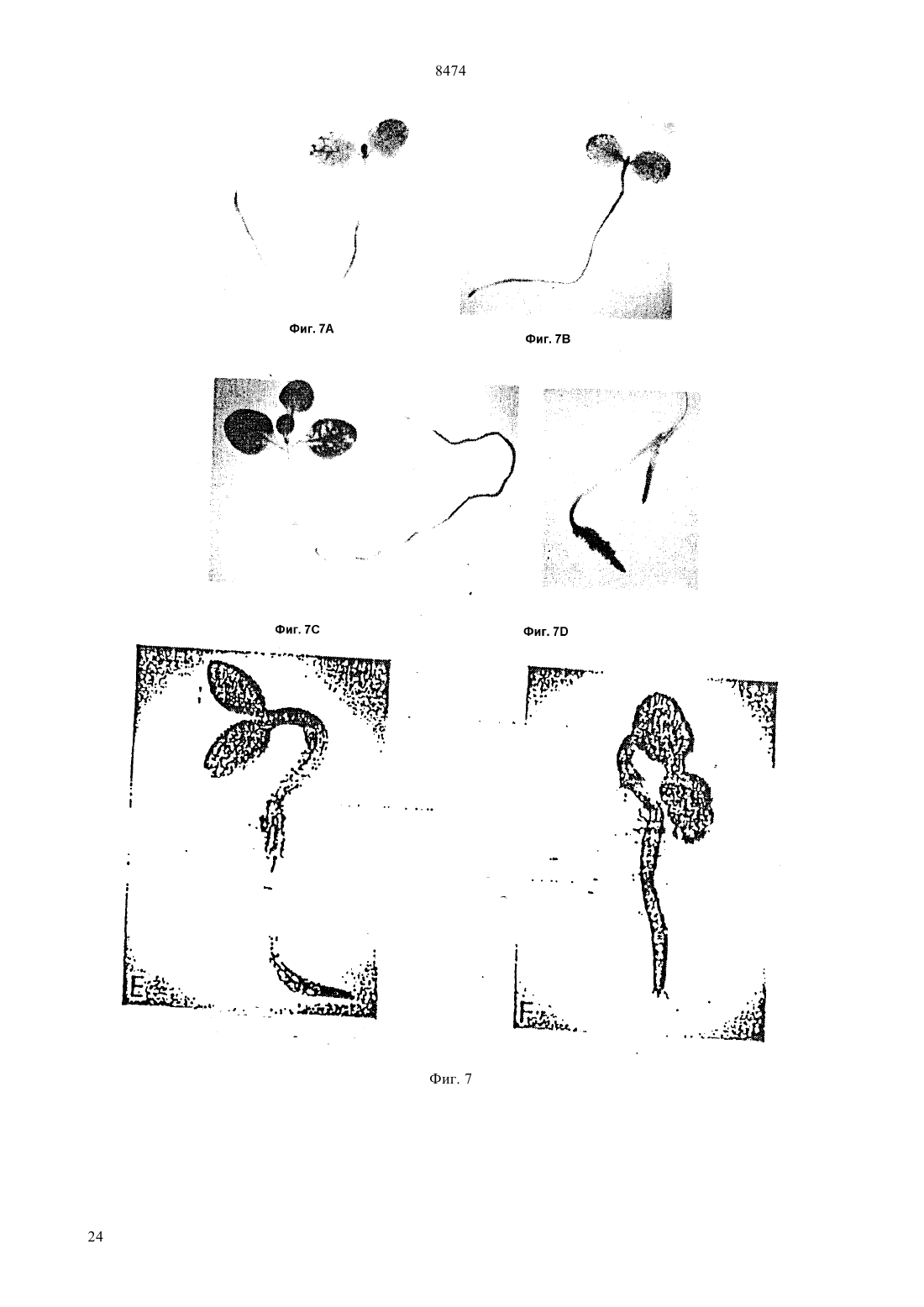
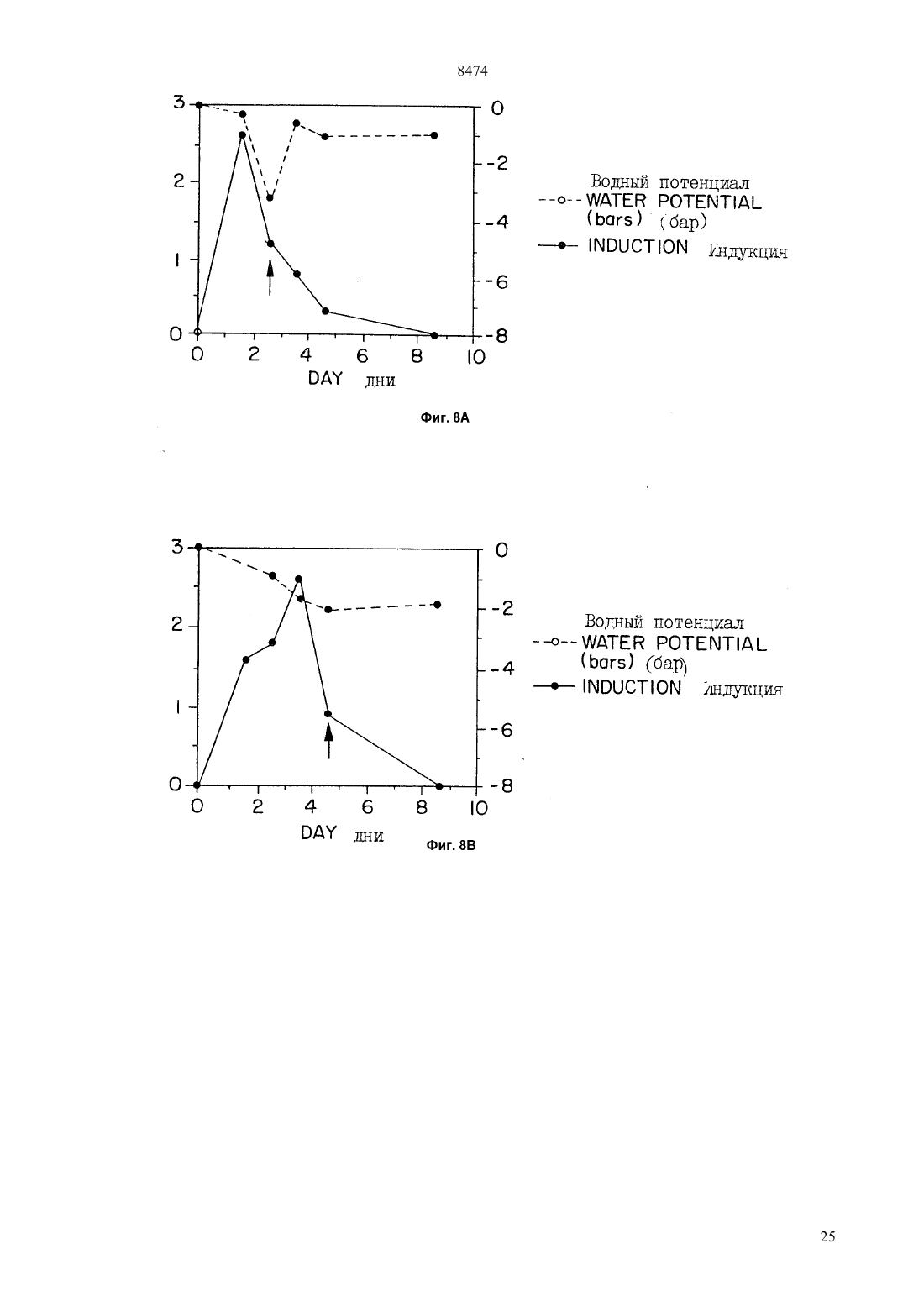
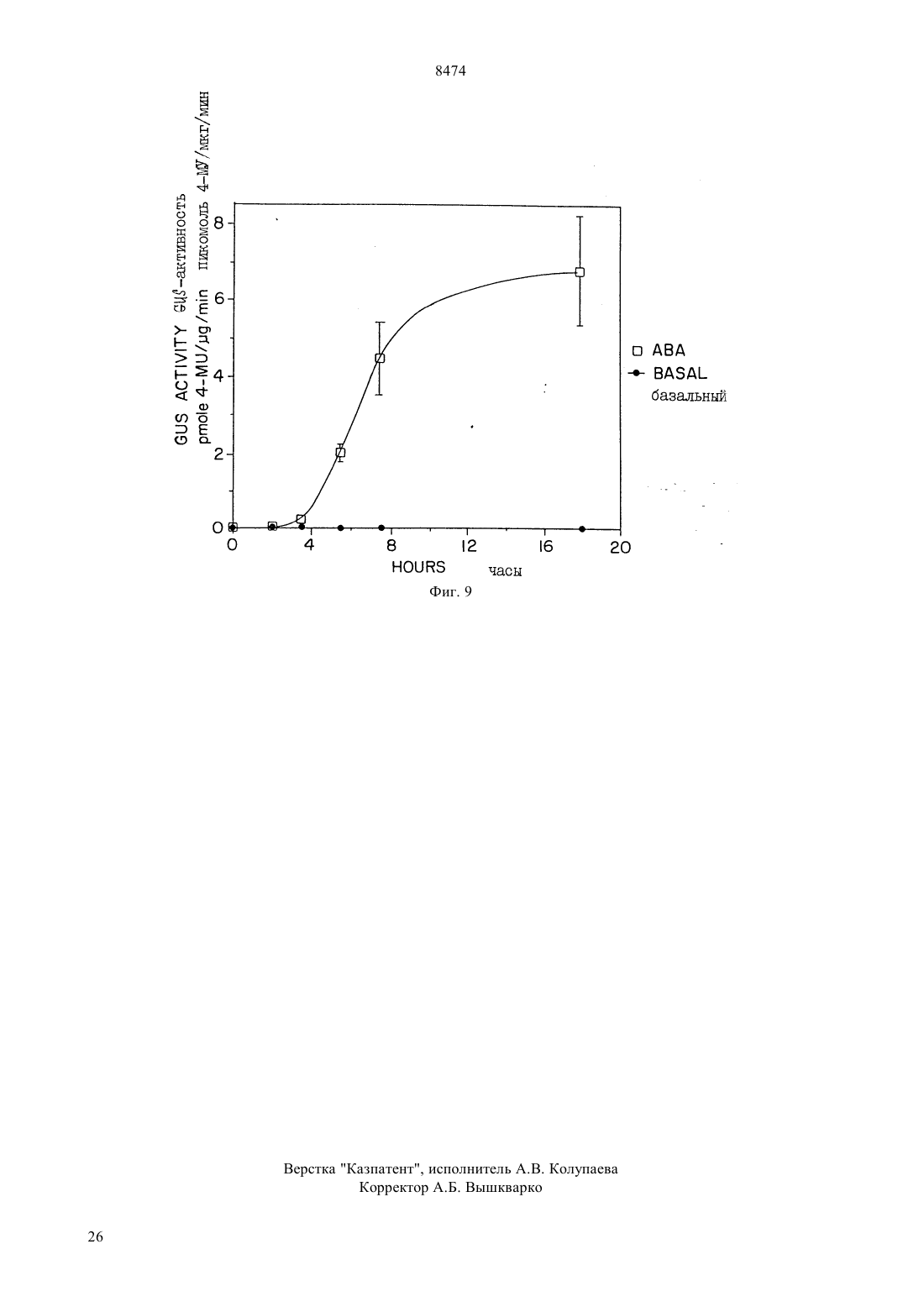
(51)6 12 5/10, 15/00 НАЦИОНАЛЬНОЕ ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(54) ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА ГЕНА ГЕЛИАНТИНИНА,ХИМЕРНЫЙ ГЕН РАСТЕНИЙ, ВЕКТОР ТРАНСФОРМАЦИИ РАСТЕНИЙ, КЛЕТКА РАСТЕНИЙ, СПОСОБ(57) Гелиантинин является 11 белком хранения семян подсолнечника. Настоящее изобретение направлено на 5 регуляторную область гена гелиантинина. В частности, настоящее изобретение направлено на специфические цис-регуляторные элементы регуляторной области, которая направляет тканеспецифичную,зависимую от времени и зависимую от абсцизовой кислоты экспрессию. Настоящее изобретение обеспечивает химерные гены, содержащие цис-регуляторные элементы, связанные с кодирующей последовательностью гетерологичного гена для осуществления контроля экспрессии этих генов. Химерные гены согласно изобретению используют для получения трансгенных растений с резистентностью к гербицидам и улучшенным липидным составом. 8474 Гелиантинин представляет собой запасный белок 11 семян подсолнечника. Настоящее изобретение относится к 5-регуляторным областям генов гелиантинина. Более конкретно, настоящее изобретение относится к специфическим цис-регуляторным элементам указанной регуляторной области, которые управляют тканеспецифической, регулируемой во времени или восприимчивой к воздействию абсцизовой кислоты экспрессией генов. Настоящее изобретение относится к химерным генам, включающим в себя цис-регуляторные элементы, сцепленные с кодирующей последовательностью гетерологичного гена для регуляции экспрессии этих генов. Химерные гены настоящего изобретения могут быть использованы для получения трансгенных растений с резистентностью к гербицидам и улучшения качества липидов семян. Развитие семян, специфическое для высших растений, включает в себя эмбриональное развитие и процессы физиологической адаптации, которые происходят в семенах, обеспечивая тем самым выживаемость развивающегося посевного материала после прорастания. После оплодотворения наблюдаются быстрый рост и дифференциация зародыша и эндосперма, после чего во время периода созревания в процессе развития семян начинают откладываться запасы питательных веществ. Эти запасы сохраняются в течение периода задержки развития для более позднего их использования развивающимися проростками. Этот период задержки развития продолжается до фазы высыхания в развитии семян. В течение эмбриогенеза аккумулируются белки зерна нескольких классов, включая запасные белки,лектины и ингибиторы трипсина. Основная функция запасных белков семян заключается в их аккумуляции во время эмбриогенеза и сохранении запасов углерода и азота для развивающихся семян после их прорастания. Этим белкам, а также генам, кодирующим эти белки, были посвящены многочисленные исследования ( и др. (1989) в, 15,, , 297). Гены, кодирующие запасные белки семян, являются в высокой степени регулируемыми и дифференциально экспрессируемыми в процессе развития семян. Эта экспрессия является регулируемой во времени мРНК, быстро аккумулирующейся во время фазы созревания в эмбриогенезе. Указанная экспрессия также является тканеспецифической и происходит главным образом в семядоле или эндосперме развивающихся семян. Образующиеся запасные белки процессируются и направляются в белковые тельца, в которых эти запасные остаются в течение периода высыхания и покоя зародыша. После прорастания семян проростки используют эти запасные белки как источник углерода и азота ( (1984). . . , 35, 191). Белки семян, включая запасные белки, лектины и ингибиторы трипсина, кодируются негомологичными мультигенными семействами, которые не амплифицируются или структурно изменяются в про 2 цессе развития ( и др., (1989)56, 149). Эти гены являются регулируемыми пространственно и во времени, но они необязательно являются связанными. Хотя посттранскрипционные механизмы направлены на регуляцию аккумулирования некоторых из этих белков, однако регуляция происходит главным образом на транскрипционном уровне. В соответствии с этим гены белков семян представляют собой прекрасную систему для поставки генетических регуляторов элементов, особенно тех элементов, которые сообщают тканеспецифичность, временную регуляцию и восприимчивость к воздействию окружающей среды и химических соединений. Наблюдения временной и пространственной регуляции генов белков семян позволяет предположить, что эти гены регулируются отчасти общими клеточными факторами, известными как трансактивирующие факторы. Однако, поскольку характер экспрессии генов белка семян имеет качественные и количественные отличия для каждого отдельного гена, то для обеспечения способов осуществления дифференциальной экспрессии для каждой конкретной группы белков семян, очевидно, должны также существовать более специфические факторы. Типы дифференциальной экспрессии наблюдались для основных запасных белков семян рапса, круциферина и напина ( и др., (1981)153, 64 и др., (1985). 78, 630) и для отдельных членов генного семейства соевого ингибитора трипсина( и др., (1989), 1, 1079). Сравнение генов основного запасного белка семян сои выявило различие в согласовании и клеточной типоспецифичности экспрессии конглицина (7) и глицинина (11). Субъединица 7 мРНК появлялась за несколько дней до мРНК 11. Кроме того, тогда как члены генного семейства глицинина активировались все одновременно, ( и др., (1989), 1, 313), члены генного семейства -конглицина регулировались дифференциально ( и др., (1988) . . . .85, 458 и др., (1989). 10, 112). Каждый из этих генов содержит ряд цис-регуляторных элементов, которые сообщают типы дифференциальной экспрессии между генными семействами или внутри данного генного семейства. Гелиантинин является сновным запасным белком семян (11 глобулином) подсолнечника . Аналогично другим запасным белкам семян, экспрессия гелиантинина является тканеспецифической и находится под эволюционным контролем. Однако регуляторные элементы гелиантинина, которые сообщают такую специфичность, до настоящего времени не были идентифицированы. Сначала была обнаружена мРНК гелиантинина в зародышах через семь дней после цветения (ДПЦ), причем максимальный уровень мРНК достигался на 12-15 ДПЦ,после чего этот уровень транскриптов гелиантинина начинал падать. В зрелых семенах или в проростках транскрипты гелиантинина отсутствовали. От 7 до 19 ДПЦ накопление полипептида гелиантинина 8474 происходило быстро, но затем замедлялось, как только семена достигали стадии созревания ( и др., (1985). . 5, 165). Как и большинство запасных белков, гелиантинин кодируется небольшим генным семейством. Известны, по крайней мере, два различных подсемейства, которые обозначаются На 2 и На 10. Были выделены и частично охарактеризованы два клона На 8- и 3-1, представляющих неаллельные члены подсемейства На 2 (и др., (1988) 74, 433). Однако детального анализа регуляторных элементов этих или любых других генов гелиантинина до сих пор не было проведено. В соответствии с настоящим изобретением было обнаружено, что регуляторные элементы генов гелиантинина могут управлять семя-специфической экспрессией гена, корне-специфической экспрессией гена, экспрессией гена, восприимчивой к воздействию абсцизовой кислоты и/или меняющейся во времени экспрессией гена. Эти регуляторные элементы способны регулировать экспрессию специфических генных продуктов в трансгенных растениях. Таким образом, настоящее изобретение позволяет осуществлять более высокую степень регулирования экспрессии генов в трансгенных растениях и тем самым дает возможность получать семена более высокого качества и с более высокой устойчивостью к условиям окружающей среды, например, таким, как засуха,а также осуществлять более высокий контроль генов устойчивости к гербицидам. Настоящее изобретение относится к 5-регуляторной области гена гелиантинина. В настоящем описании эта область будет иметь название 5 концевой регуляторный ансамбльи будет использована для регулирования экспрессии гетерологичных белков.включает в себя несколько регуляторных элементов, которые сообщают различные типы регулируемой экспрессии гетерологичным генам, вызывают экспрессию в трансгенных растениях, при связывании с кодирующими областями этих гетерологичных генов. В частности, настоящее изобретение относится к выделенной ДНК, содержащей регуляторные элементы гелиантинина, которые способны регулировать семя-специфическую экспрессию гена, корнеспецифическую экспрессию гена, экспрессию гена,восприимчивую к воздействию абсцизовой кислоты(АВА) и/или меняющуюся во времени экспрессию гена. В другом своем варианте настоящее изобретение относится к химерным генам растений, содержащих указанные регуляторные элементы. Эти регуляторные элементы являются соответствующим образом связанными с кодирующей последовательностью гетерологичного гена таким образом, что указанный элемент способен регулировать экспрессию продукта, кодированного гетерологичным геном. Если необходимо, в конструкции химерных генов могут быть включены дополнительные промоторные элементы или части этих элементов. В объем настояще го изобретения также входят векторы трансформации растений, включающие в себя химерные гены по настоящему изобретению, растительные клетки,трансформированные этими векторами, и растения и их потомство, содержащие указанные химерные гены. В другом своем варианте по настоящему изобретению предусматривается способ продуцирования растения, обладающего более высоким качеством семенных липидов. В соответствии с настоящим изобретением, сконструированные химерные гены,содержащие регуляторный элемент, который способен регулировать семя-специфическую экспрессию,связан с кодирующей областью гена, которая кодирует фермент липидного метаболизма. Если растительные клетки трансформировать этим химерным геном, то могут быть регенерированы растения с улучшенным качеством липидов семян. В еще одном своем варианте настоящее изобретение относится к способу продуцирования растений, обладающих резистентностью к гербицидам. Например, в соответствии с настоящим изобретением, конструируются химерные гены, в которых корне-специфический регуляторный элемент управляет экспрессией гербицид-резистентного гена. Поэтому с помощью растительных клеток, трансформированных указанным химерным геном, могут быть регенерированы растения, обладающие устойчивостью к гербицидам. На фиг. 1 изображена нуклеотидная последовательностьгена На 3-А гелиантинина. Номера нуклеотидов от -2377 до 24 на фиг. 1 соответствуют номерам нуклеотидов 1-2401 последовательности 1 под 1. На фиг. 2 изображена нуклеотидная последовательность частигена На 3 гелиантинина. Номера нуклеотидов от -2457 до -726 на фиг. 2 соответствуют номерам нуклеотидов от 1 до 1732 последовательности 2. На фиг. 3 представлена нуклеотидная последовательность частигена На 3- гелиантинина. Номера нуклеотидов от -725 до -322 на фиг. 3 соответствуют номерам нуклеотидов от 1 до 404 последовательности 3. В гене На 3- нуклеотидная последовательность, изображенная на фиг. 3, находится непосредственно ниже (3) последовательности, изображенной на фиг. 2 На фиг. 4 показаны /-конструкция На 3 и контрольные конструкции рВ 121.1 и рВ 1101.1. На фиг. 5 представлены рестрикционная карта геномных клонов На 3- и 3- гелиантинина и рестрикционные фрагмены, используемые для конструирования родительских плазмид. На фиг. 6 изображены конструкции На 3- и 3-, которые являются производными по отношению к конструкции с полной длиной. На фиг. 7 проиллюстрирована гистохимическая локализация -активности в трансгенных проростках, содержащих конструкции 3 и 3-/.3404, 8 дней после набухания 3(ДПН) В 3/, 8 ДПН С 3404,1413/, 14 ДПН Е 38 ДПН 3/, 6 ДПН. На фиг. 8 графически проиллюстрировано индуцирование -активности в листьях трансгенного табака, содержащих конструкцию 3404, в течение прогрессирующего высыхания с последующей компенсацией недостатка воды. На фиг. 9 графически проиллюстрировано АВАиндуцирование -экспрессии в листьях табака,содержащих 3404. В настоящем описании раскрываются цисрегуляторные элементы 5-концевого регуляторного ансамблягенов гелиантинина подсолнечника. Эти цис-регуляторные элементы являются дискретными областями , под контролем которых происходит регулируемая экспрессия гена. В частности, настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей, по крайней мере,один регуляторный элемент из гена гелиантинина, и регулирующий, по крайней мере, одну из следующих экспрессий гена семя-специфическую экспрессию, корне-специфическую экспрессию, АВАвосприимчивую экспрессию или изменяющуюся со временем экспрессию гена. Указанные регуляторные элементы могут происходить от любого гена гелиантинина, например, от генов На 2 и На 10, которые являются представителями двух разных подсемейств генов гелиантинина. В предпочтительном варианте осуществления настоящего изобретения такими генами гелиантинина являются 3- и 3-гены, которые являются членами подсемейства На 2. Один из рассматриваемых регуляторных элементов контролирует семя-специфическую экспрессию. Семя-специфический регуляторный элемент представляет собой конкретную нуклеотидную последовательность, способную вызвать экспрессию гена под своим контролем, которая имеет место в семени,то есть экспрессию гена, обнаруживаемую в семени. Семя-специфическая экспрессия может происходить в любой части семени, например, в семядолях и эмбрионных стволах зародыша и в эндосперме. Однако эта экспрессия гена не наблюдается в проростках или соматических тканях зрелого растения для генов под семя-специфическим контролем. Для идентификации регуляторных элементов,управляющих семя-специфической экспрессией,может быть осуществлен делеционный анализ полногогена гелиантинина. В делиционном анализе нуклеотиды последовательно удаляют из полного, и полученные фрагменты лигируют с кодирующей последовательностью гена-репортера или другого гетерологичного гена. Затем конструкции анализируют на их способность к регулированию семя-специфической экспрессии путем обнаружения присутствия продукта гена-репортера в тканях семян, но не в других тканях. Семя-специфичные элементы, которые были идентифицированы, могут быть также модифицированы, например, с помощью сайт-направленного мутагенеза. Эти модифициро 4 ванные регуляторные элементы могут быть затем проанализированы на их способность к регулированию семя-специфической экспрессии, что позволяет идентифицировать альтернативные последовательности, несущие семя-специфичность. Описанная техника идентификации регуляторных элементов может быть применена ко всем генам гелиантинина. Например, в предпочтительном варианте осуществления настоящего изобретения анализгена 3- гелиантинина показал, что семя-специфические регуляторные элементы определяются нуклеотидами 851-2401 и нуклеотидами 1-2401 в последовательности под 1. Другие регуляторные элементы настоящего изобретения управляют корне-специфической экспрессией. Корне-специфическая экспрессия представляет особый интерес и важность. Обычно ген гелиантинина подсолнечника экспрессируется только в семенах. При выделении конкретных областейгелиантинина из полногов соответствии с настоящим изобретением экспрессия локализуется исключительно в корнях растений. Корнеспецифический регуляторный элемент представляет собой конкретную нуклеотидную последовательность, обладающую способностью вызывать экспрессию гена под своим контролем, которая имеет место лишь в корнях растения, но не в других тканях растения. Регуляторные элементы, управляющие корне-специфической экспрессией, могут быть идентифицированы путем анализа фрагментовгелиантинина на их способность сообщать корнеспецифическую экспрессию, который осуществляют способом, аналогичным описанному выше для идентификации семя-специфических регуляторных элементов, за исключением того, что указанная экспрессия обнаруживается в тканях корней растений. Модификации нуклеотидных последовательностей,которые стимулируют корне-специфическую экспрессию, могут быть также идентифицированы, как описано выше. С помощью указанной техники могут быть идентифицированы корне-специфические регуляторные элементы, происходящие от любого гена гелиантинина. Например, в предпочтительном варианте осуществления настоящего изобретения анализгена 3- гелиантинина показывает, что нуклеотиды 1-1639 и нуклеотиды 831-1639 в последовательности 1 ответственны за корнеспецифические регуляторные элементы. Экспрессия гелиантинина происходит под строгим временным контролем с участием мРНК, впервые обнаруживаемой на 12 ДПЦ. В соответствии с этим было обнаружено, что существуют цисрегуляторные элементы, сообщающие изменяющуюся во времени экспрессию гена, обнаруживаемую уже примерно на 4 день после цветения (ДПЦ). Для идентификации регуляторных элементов, сообщающих временную экспозицию гена, может быть осуществлен делеционный анализ всегогена гелиантинина. Фрагментысвязывают с кодирующей последовательностью гетерологичного 8474 гена, и полученную химерную конструкцию используют для трансформации растений. Семена от трансформированных растений выращивают до определенных стадий после цветения (дни после цветения, ДПЦ), после чего эти семена анализируют на обнаружение экспрессии гетерологичного гена. Элементы, регулирующие экспрессию гетерологичного гена примерно до 10 ДПЦ, были идентифицированы как элементы, вызывающие меняющуюся во времени экспрессию. Модификации нуклеотидных последовательностей таких элементов, сообщающих нужный фенотип, могут быть идентифицированы, как описано выше. Указанная техника идентификации регуляторных элементов, которые сообщают изменяющуюся во времени экспрессию гена, может быть применена ко всем генам гелиантинина. В предпочтительном варианте осуществления настоящего изобретения анализгена На 3-А гелиантинина показывает, что элементы, регулирующие временную экспрессию гена, представлены нуклеотидами 1-851 и 1639-2303 в последовательности 1. В другом своем варианте настоящее изобретение относится к областямгелиантинина, которые стимулируют экспрессию гена, восприимчивую к воздействию абсцизовой кислоты (АВА). АВАвосприимчивый элемент представляет собой конкретную нуклеотидную последовательность, которая способна вызывать экспрессию гена под своим контролем в ответ на воздействие АВА. Экспрессия гена под контролем АВА-восприимчивого элемента может быть индуцирована путем обработки абсцизовой кислотой (АВА) или внешними раздражителями, которые известны как стимуляторы АВАбиосинтеза. Например, АВА-биосинтез инициируется в результате потери тургора, вызванного стрессами, обусловленными состоянием окружающей среды, включая недостаток воды, водным стрессом и солевым стрессом ( и др., (1988) . .. 39, 439). Уровни АВА также возрастают в ответ на скарификацию (и др.,(1989) . . . .86, 9851). АВАвосприимчивые элементы идентифицируют, как описано выше для идентификации других регуляторных элементов. Например, для идентификации нуклеотидных последовательностей любого гена гелиантинина, которые индуцируют экспрессию гена под своим контролем в ответ на воздействие АВА,может быть использован делеционный анализ. Эти последовательности могут быть модифицированы,как описано выше, а затем проанализированы для идентификации альтернативных последовательностей, индуцирующих АВА-восприимчивую экспрессию. В одном из предпочтительных вариантов осуществления настоящего изобретения анализгена На 3-А гелиантинина показал, что элемент,ответственный за АВА-восприимчивую экспрессию в семенах, представлен нуклеотидами 1-2401 в последовательности 1. В другом из предпочтительных вариантов осуществления настоящего изобретения было установлено, что элемент, индуцирующий АВА-восприимчивую экспрессию в листьях зрелого растения, соответствует нуклеотидам 851-1639 или 1639-2303 в последовательности 1. В еще одном предпочтительном варианте осуществления настоящего изобретения анализгена На 3- гелиантинина показал, что нуклеотиды 1-404 последовательности 3 соответствуют области, индуцирующей АВА-восприимчивую экспрессию в неэмбрионных тканях растений. В соответствии с вышеуказанным, ценность АВА-восприимчивых элементов заключается в том,что специфические условия окружающей среды могут инициировать АВА-биосинтез и тем самым индуцировать экспрессию генов под контролем АВАвосприимчивых элементов. Экспрессия гетерологичных генов под контролем АВА-восприимчивых элементовгелиантинина не ограничивается лишь семенами, но также наблюдается в листьях эрелых растений и в тканях проростков. Выделенная нуклеиновая кислота, кодирующая 5-концевой регуляторный ансамбль гена гелиантинина, может быть получена следующим образом. Рекомбинантные геномные клоны гелиантинина выделяют путем скрининга геномной ДНКбиблиотеки подсолнечника с рекомбинантной кДНК,представляющей мРНК гелиантинина ((1988) , 74, 433). Для получения геномных рекомбинантных ДНК гелиантинина могут быть использованы методы, описанныеи др.,(1989) в,, , либо в любом из многочисленных руководств по технике рекомбинантных ДНК, которые имеются в настоящее время. Для определения нуклеотидных последовательностей существует множество способов, хорошо известных каждому специалисту в этой области. Например, рестрикционные фрагменты, содержащиегелиантинина, могут быть субклонированы в сайт полилинкера секвенирующего вектора, такого, как. Эти -субклоны могут быть затем секвенированы с помощью двухнитевого дидезокси-метода (С и(1985), 4, 165). Нуклеотидная последовательность для ДНК, кодирующейклона гена На 3-А гелиантинина,показана на фиг. 1 и представлена как последовательность 1. Аналогично нуклеотидная последовательность для ДНК, кодирующей областьклона На 31 гелиантинина, показана на фиг. 2 и представлена ниже как нуклеотидная последовательность 2.других генов гелиантинина могут быть получены аналогичным образом. Наоборот,клоны, представляющие другие члены семейства генов гелиантинина, могут быть получены с использованием кодирующих На 3 А- или На 3 последовательностей или -последовательностей настоящего изобретения в качестве гибридизационных зондов для скрининга геномной библиотеки гелиантинина и идентификации дополнительных генов гелиантинина. 5 8474 Идентификация цис-регуляторных последовательностей, которые осуществляют временную, тканеспецифическую и АВА-чувствительную регуляцию, может быть осуществлена путем транскрипционного лигирования специфических последовательностей с кодирующей последовательностью гетерологичного гена, последующего переноса химерного гена в подходящего хозяина и определения экспрессии гетерологичного гена. Выбор метода для обнаружения экспрессии зависит от природы гетерологичной последовательнтости. Например, для оценки транскрипционной и трансляционной способности химерных конструкций обычно используют генырепортеры, идентифицированные с помощью хлорамфениколацетилтрансферазы и -глюкуронидазы. Имеются также стандартные анализы для чувствительного обнаружения репортерного фермента в трансгенном организме. Ген -глюкуронидазы может быть использован в качестве поставщика (репортера) промоторной активности в трансгенных растениях табака вследствие высокой стабильности этого фермента в клетках табака, недостатка -глюкуронидазной активности в высших растениях и доступности качественного флуориметрического анализа и гистохимической техники локализации.и др., (1987),., 6, 3901) разработали стандартные процедуры для биохимического и гистологического обнаружения активности в тканях растений. Биохимический анализ осуществляют путем смешивания лизатов растительной ткани с 4-метилумбеллиферилглюкуронидом, флуориметрическим субстратом для ,инкубирования при 37 С в течение одного часа и последующего измерения флуоресценции полученного 4-метилумбеллиферона. Гистохимическую локализацию для -активности определяют путем инкубации образцов ткани растений в 5-бромо-4 хлоро-3-индолил-глюкурониде (Х-) в течение 18 часов при 37 С с последующим наблюдением характера окрашивания Х-. Конструирование таких химерных генов позволяет определить специфические регуляторные последовательности, необходимые для регулирования экспрессии, и дает возможность проиллюстрировать тот факт, что эти последовательности могут регулировать экспрессию гетерологических генов анализируемым способом. В другом своем варианте настоящее изобретение относится к химерному гену растения, содержащему регуляторный элемент гена гелиантинина, индуцирующий семя-специфическую экспрессию гена, корне-специфическую экспрессию гена,АВАвосприимчивую экспрессию гена или временную экспрессию гена, причем указанный химерный ген лигируют с кодирующей последовательностью гетерологичного гена так, чтобы регуляторный элемент был способен регулировать экспрессию продукта,кодированного гетерологичным геном. Таким гетерологичным геном может быть любой ген, не являющийся геном гелиантинина. Если необходимо,то в химерные конструкции могут быть включены 6 дополнительные промоторные элементы или части этих элементов, достаточные для индуцирования экспрессии, которая приводит к продуцированию эффективного количества полипептида, кодированного гетерологичным геном. В соответствии с вышеуказанным, настоящее изобретение относится к химерным генам, содержащим областигелиантинина, которые индуцируют семя-специфическую экспрессию в соответствии с настоящим изобретением и которые связаны с последовательностью, кодирующей фермент липидного метаболизма, такой, как десатураза. В предпочтительном варианте осуществления настоящего изобретения областисоответствуют нуклеотидам 851-2401 или 1-2401 На 3, как показано в последовательности 1. Может быть рассмотрена любая модификация, стимулирующая семя-специфическую экспрессию. Семена аккумулируют и сохраняют белки и липиды, которые имеют важное агрономическое значение. Поскольку элементыгелиантинина могут индуцировать в высокой степени регулируемую экспрессию в развивающихся семенах, то эти элементы могут быть использованы для повышения качества липида и/или белка семян. Эти элементы могут быть использованы для регулирования экспрессии генов, кодирующих ферменты липидного метаболизма, таких, которые участвуют в удлинении и десатурации жирных кислот и/или белков, особенно белков с высоким содержанием лизина и метионина. Химерные гены, содержащие указанные элементы, могут быть использованы для получения линий трансгенных растений, которые аккумулируют и хранят значительные количества липидов и/или белков определенных классов. В другом своем варианте настоящее изобретение относится к химерным генам, содержащим областьгелиантинина, которая индуцирует корнеспецифическую экспрессию, соединенную с гетерологичным геном. Эта конструкция индуцирует экспрессию, которая пространственно отличается от нормальной экспрессии гелиантинина тем, что указанный гетерологичный ген экспрессируется исключительно в корнях растений. Другими словами,если специфическую последовательность удалить из полного регуляторного ансамбля , то в тканеспецифической регуляции произойдет изменение. В предпочтительном варианте осуществления настоящего изобретения -область На 3-А соответствует нуклеотидам 1-1639 или 851-1639 в последовательности 1 и присоединена к промотору в обратной ориентации, хотя эти элементы функционируют в любой ориентации. В другом предпочтительном варианте осуществления настоящего изобретения последовательность, сообщающая растению резистентность к гербицидам, представляет, по крайней мере, часть гена аоА. В объем настоящего изобретения входит любая модификация этих последовательностей, которая индуцирует корне-специфическую экспрессию. 8474 Особый интерес представляют химерные конструкции, сообщающие растению резистентность к гербицидам. Поскольку большинство гербицидов оказывает свое токсическое воздействие не только на сорняки, но и на культурные растения, то получение устойчивых к гербицидам растений имеет особо важное значение в агротехнике, поскольку оно позволяет использовать гербициды широкого спектра. В соответствии с этим настоящее изобретение относится к химерным генам, содержащим элементыгелиантинина, которые индуцируют корнеспецифическую экспрессию и которые соединены,по крайней мере, с частью промотора, функционирующего в растениях, а также соединены, по крайней мере, с частью гена аоА или последовательностью, кодирующей полипептид, несущий резистентность к гербицидам. В настоящем изобретении рассматриваются полипептиды, которые сообщают растению устойчивость к глифосату и родственным ингибиторам 5-энолпировилшикимат-3-фосфатсинтетазы (ЕРР-синтетазы), сульфонилмочевинам, имидазолинонам и ингибиторам ацетолактазосинтетазы(А) и ацетогидрооксикислой синтетазы (АН). В предпочтительном варианте осуществления настоящего изобретения -области соответствуют нуклеотидам 1-1639 или 851-1639 На 3-А в последовательности 1 и являются сцепленными в обратной ориентации с промотором. В настоящем изобретении рассматривается любая модификация, которая индуцирует корне-специфическую экспрессию. В другом своем варианте настоящее изобретение относится к химерным генам, содержащим элементыгелиантинина, которые индуцируют изменяющуюся во времени экспрессию и которые соединены в прямой или обратной ориентации, по крайней мере, с частью промотора, функционирующего в растениях, а также с кодирующей областью гетерологичного гена. В предпочтительном варианте осуществления настоящего изобретения эти элементысоответствуют нуклеотидам 1-851 или 16392303 На 3-А в последовательности 1. В объем настоящего изобретения входит любая модификация этих последовательностей, индуцирующая временную экспрессию гена. Настоящее изобретение также относится к химерным генам, содержащим элементыгелиантинина, которые индуцируют АВА-экспрессию и которые являются необязательно присоединенными в прямой или обратной ориентации, по крайней мере, с частью промотора, функционирующего в растениях, а также с гетерологичным геном. В предпочтительном варианте настоящего изобретения эти элементысоответствуют нуклеотидам 852-1639 или 1639-2303 На 3-А в последовательности 1,или нуклеотидам 1-404 На 3- в последовательности 3. Особый интерес представляют конструкции, индуцирующие АВА-восприимчивую экспрессию и тем самым сообщающие растениям повышающие устойчивость к водным стрессам. Химерные гены настоящего изобретения конструируют путем лигирования 5-фланкирующей последовательности геномной ДНК гелиантинина с кодирующей последовательностью гетерологичного гена. Присоединение этих последовательностей может быть осуществлено различными способами. В предпочтительном варианте настоящего изобретения указанные последовательности расположены в следующем порядке (от 5 к 3) вверху регуляторная область гелиантинина, затем промоторная область,кодирующая последовательность, и сайт полиаденилирования. Способы конструирования таких химерных генов хорошо известны каждому специалисту и могут быть легко найдены в специальной литературе, например,и др., (1989). Для лигирования фрагментов ДНК существует несколько стратегий,выбор которых зависит от природы концов ДНКфрагментов. Каждому специалисту известно, что для экспрессии гетерологичного гена необходимо, чтобы конструкция содержала промоторные элементы и сигналы для эффективного полиаденилирования транскрипта. В соответствии с этим 5-областигелиантинина, которые содержат промоторные последовательности, известные, как СААТ- и ТАТАблоки, могут быть непосредственно присоединены к гетерологичной последовательности, не имеющей промотора. Альтернативно-области гелиантинина, которые не содержат СААТ- и ТАТА-блоки,могут быть присоединены к ДНК-фрагменту, кодирующему промотор, который функционирует в растениях. В этих целях могут быть использованы коммерческие растительные промоторы, либо они могут быть химически синтезированы, исходя из их известных последовательностей. Примером вышеуказанного фрагмента может служить усеченный промотор 35 вируса мозаики цветной капусты, который содержит СААТ- и ТАТА-блоки. Другими типичными промоторами являются промотор нопалинсинтетазы и рибулозо-1,5-бифосфаткарбоксилазы. Промоторный фрагмент, кроме того, сшивают с гетерологической кодирующей последовательностью. 3-конец кодирующей последовательности сшивают с сайтом полиаденилирования, примером которого является, но не ограничивается им, сайт полиаденилирования нопалинсинтетазы. Кроме того, существуют векторы, трансформирующие растения, которые содержат один или несколько указанных сайтов полиаденилирования, граничащих с последовательностями, необходимыми для трансформации растений. Элементыгелиантинина и гетерологичные кодирующие последовательности настоящего изобретения могут быть субклонированы в сайт полилинкера трансформирующего растение вектора для получения химерных генов. 5-фланкирующие элементы по настоящему изобретению могут быть получены в результате переваривания геномного клона гелиантинина рестриктирующей эндонуклеазой или экзонуклеазой. Эти рестрикционные фрагменты, содержащие СААТ- и 7 8474 ТАТА-блоки гелиантинина, лигируют в прямой ориентации с гетерологичным геном, не содержащим промотора, например,геном, кодирующим глюкуронидазу . Каждому специалисту ясно,что 5-регуляторные последовательности гелиантинина могут быть получены и другими способами,например, путем химического или ферментного синтеза. Указанным гетерологичным геном может быть кодирующая последовательность любого гена, который может быть экспрессирован в данной конструкции. Описанные способы также входят в объем настоящего изобретения. 3-конец кодирующей последовательности может быть факультативно лигирован с сайтом полиаденилирования, примером которого является, но не ограничивается им, сайт полиаденилирования нопалинсинтетазы, или сайт полиаденилирования гена 7 Т-ДНК октопина. Альтернативно сайт полиаденилирования может обеспечиваться гетерологичным геном. 5-регуляторные элементы гелиантинина, которые не содержат ТАТА-блок, могут быть лигированы в прямой или обратной ориентации, по крайней мере, с частью последовательности растительного промотора, т. е., промоторной последовательности,содержащей, по крайней мере, СААТ- и ТАТАпоследовательности. В предпочтительном варианте настоящего изобретения указанным промотором является усеченный промотор 35 вируса мозаики цветной капусты (СаМ). Полученный в результате химерный комплекс может быть лигирован с гетерологичной кодирующей последовательностью или последовательностью полиаденилирования. Для индуцирования регулируемой экспрессии гетерологичных генов растения трансформируют химерной генной конструкцией настоящего изобретения. Перенос генов является хорошо известным способом, применяемым для экспрессии гетерологичных генов в трансгенных растениях. В качестве хозяина чаще всего используют растение табака, поскольку оно легко регенерируется, дает большое количество жизнеспособных семян на одно растение и может быть трансформировано с высокой степенью частоты с помощью Т-плазмидного вектора, происходящего от( и др., (1987). .. 38 467). В качестве трансгенных хозяев предпочтительными являются двудольные растения, такие, как хлопчатник, масличный рапс и соя. Однако каждому специалисту ясно,что в качестве трансгенного растения в настоящем изобретении может быть использовано любое растение, которое может быть эффективно трансформировано и регенерировано. Известно несколько способов трансформации. Химерные гены могут быть введены в растения с помощью процедуры трансформации-регенерации листовых дисков, описаннойи др., (1985)227, 1229). В целях настоящего изобретения могут быть использованы и другие способы трансформации, которые также входят в объем настоящего изобретения, например, такие, как культивирова 8 ние протопластов ( и др., (1984)223,496 и др., (1984) ЕМВО ., 2, 2143 и др., (1983) С, 32, 1033) или трансформация эксплантатов стебля или корня( и др.,(1983) ЕМВО ., 2, 2143 и др., (1983), С,32, 1033). В предпочтительном варианте осуществления настоящего изобретения растения трансформируют векторами, происходящими от . Однако для вставки химерных генов по настоящему изобретению в растительные клетки могут быть использованы и другие методы. Такими альтернативными методами являются электропорация( и др., , 1987, 327, 70), химически индуцированное внедрение ДНК и использование вирусов или пыльцы в качестве векторов. Если необходимо, то химерные гены по настоящему изобретению могут быть введены в вектор трансформации растения, например, бинарный вектор, описанный(1984). Векторы для трансформации растений могут быть получены путем модификации натуральной системы для переноса гена,происходящей от. Эта натуральная система представляет собой большую Т (опухольиндуцирующую) - плазмиду, содержащую большой сегмент, известный как Т-ДНК, который переносится в трансформированное растение. Другой сегмент Т-плазмиды, а именно, -область,является ответственным за перенос Т-ДНК. Т-ДНКобласть имеет на своих границах концевые повторы. В модифицированных бинарных векторах опухольиндуцирующие гены были делецированы, и функции-области были использованы для переноса чужеродной ДНК, имеющей на своих границах пограничные Т-ДНК-последовательности. Т-область также содержит селектируемый маркер на резистентность к антибиотику и сайт множественного клонирования для инсерции переносимых последовательностей. Сконструированные таким образом штаммы известны как обезвреженные штаммы А.,которые позволяют осуществлять эффективную трансформацию последовательностей, окаймленных Т-областями, в нуклеарные геномы растений. Листовые диски со стерилизованной поверхностью инокулировали обезвреженной А.,содержащей чужеродную ДНК и культивированной в течение двух дней, а затем переносили на среду,содержащую антибиотик. После укоренения в среде,содержащей антибиотик, трансформированные побеги отбирали и переносили в почву. Трансгенные растения подвергали самоопылению, а семена от этих растений собирали и культивировали на среде,содержащей соответствующий антибиотик. Экспрессия гетерологичного или репортерного гена в развивающихся семенах, молодых проростках и зрелых растениях может быть проконтролирована с помощью иммунологического и гистохимического анализа на активность. Как указывалось выше, выбор анализа на экспрессию химерного гена зависит от природы гетерологичной кодирующей области. Например, для 8474 оценки транскрипции может быть использован Нозерн-анализ, если имеются подходящие нуклеотидные зонды. Если имеются антитела к полипептиду,кодированному гетерологичным геном, то для оценки продуцирования и локализации полипептида могут быть использованы Вестерн-анализ и иммуногистохимический анализ на локализацию. В зависимости от гетерологичного гена, может быть использован соответствующий биохимический анализ. Например, ацетилтрансферазы могут быть обнаружены путем оценки ацетилирования стандартного субстрата. Экспрессия гена резистентности к гербициду может быть обнаружена путем оценки трансгенного растения на резистентность к гербициду. В другом своем варианте настоящее изобретение относится к трансгенным растениям или их потомству, содержащим химерные гены по настоящему изобретению. В целях настоящего изобретения могут быть использованы как однодольные, так и двудольные растения. Растительные клетки трансформируют химерными генами с использованием любого из имеющихся методов трансформации растений,описанных выше. Трансформированные клетки растений, обычно в каллюсной культуре или листовых дисках, регенерируют в полное трансгенное растение хорошо известными способами ( и др.,(1985)227, 1129). В предпочтительном варианте осуществления настоящего изобретения трансгенными растениями являются хлопчатник,масличный рапс, кукуруза, табак или соя. Поскольку потомство трансформированных растений наследует химерные гены, то для сохранения линии трансгенного растения используются семена или черенки от трансформированных растений. Настоящее изобретение также относится к способу продуцирования растения с улучшенными качествами липидов семян. Этот способ заключается в том, что клетку растения трансформируют с помощью вектора, содержащего химерный ген, включающий в себя семя-специфический регуляторный элемент, присоединенный к кодирующей последовательности фермента липидного метаболизма, такого,как десатураза, а затем производят отбор растения с нужными характеристиками. В предпочтительном варианте осуществления настоящего изобретения регуляторный элемент соответствует нуклеотидам 1-2401 или 851-2401 На 3-А, показанным в последовательности 1. Трансформированные клетки растений регенерируют в растения для улучшения качества липидов семян. В другом варианте настоящее изобретение относится к способу продуцирования растения с улучшенным качеством белков семян. Этот способ заключается в том, что растительную клетку трансформируют вектором, содержащим химерный ген,который включает в себя семя-специфический регуляторный элемент, присоединенный к кодирующей последовательности запасного белка семян с высоким содержанием лизиновых и/или метиониновых остатков, а затем производят отбор растений с нуж ными характеристиками. В предпочтительном варианте осуществления настоящего изобретения регуляторный элемент соответствует нуклеотидам 1-2401 или 851-2401 На 3-А, представленным в последовательности 1. Трансформированные клетки растений регенерируют в растения для улучшения качества белка семян. В еще одном своем варианте настоящее изобретение относится к способу продуцирования растений, обладающих резистентностью к гербицидам. Клетки растений трансформируют вектором, содержащим химерный ген, который включает в себя корне-специфический регуляторный элемент, лигированный с кодирующей последовательностью гена резистентности к гербицидам, такого, как ген резистентности к глифосату, после чего отбирают растения, обладающие резистентностью к нужному гербициду. Отбор производят по принципу выживаемости растения после его обработки гербицидом, который уничтожает нетрансформированные растения того же вида и в тех же условиях. В предпочтительном варианте настоящего изобретения регуляторный элемент соответствует нуклеотидам 1-1639 или 8511639 На 3-А последовательности 1, а гетерологичная последовательность поставляется геном,кодирующим ЕРР-синтетазу, ацетолактазосинтетазу, ацетооксисинтетазу. После этого трансформированные клетки растений регенерируют в растения,обладающие резистентностью к гербицидам. В предпочтительном варианте осуществления настоящего изобретения растения трансформируют с помощью вектора рРА-М-803, который содержит корне-специфический регуляторный элемент, соответствующий нуклеотидам 851-1639 На 3-А и аоАген устойчивости к гербициду. В целях иллюстрации настоящего изобретения ниже приводятся следующие примеры. Пример 1 Общие методы Нуклеотидные последовательности, указанные в приведенных ниже примерах, пронумерованы в соответствии с фиг. 1-3. Конструирование гена-репортераИспользуемые в настоящих примерах кассеты генов-репортеровобщего назначения были описаны ранееи др., (1987) ЕМВО . 6,3901). Короче говоря, кодирующую областьлигировали с 5-концом сайта полиаденилирования нопалинсинтетазы в области полилинкера вектора рВ 19 из .( (1984). 12, 8711). Вектор рВ 19 содержит слева и справа от Т-ДНК пограничные последовательности, необходимые для трансформации растений, а также ген резистентности к канамицину. Полученная конструкция рВ 1101.1 изображена на фиг. 4. Уникальные сайты рестрикции, расположенные выше кодона инициации (А) , позволяют инсертировать ДНК-фрагменты промотора. Промотор 35 лигировали в - и-сайты рВ 1101.1 для создания рВ 1121.1, изо 9 8474 браженной на фиг. 4. Для построения рВ 1120 промотор 35 усекали у Есо-сайта у нуклеотида - 90 (оставляя СААТ и ТАТА-блоки) и клонировали в полилинкерный сайт рВ 1101.1. В табл. 1 описаны родительские плазмиды и производные конструкции. На 3-А- и контрольные конструкции рВ 1121.1 и рВ 1101.1 изображены на фиг. 4. На фиг. 5 показаны рестрикционные фрагменты геномных клонов На 3-А и На 3-,использованные для конструирования родительских плазмид. На фиг. 6 показаны схематически производные конструкции по отношению к полной конструкции. На 3-А/-конструкции представляют большие перекрывающиеся фрагменты, которые расположены по всей длине регуляторной области (-237724, фиг. 1). 3-концы нескольких конструкций были получены в результате переваривания 2,8 кв - На 3 А-фрагмента вНа 32.8 (1 1), табл. 1 эндонуклеазой . Эти делеции показаны в верхней части фиг. 4. Первая делеция, р На 3-А-2,4, содержит СААТ- и ТАТА-блоки На 3 А, где ее 3-конец находится у -75. Фрагменты, содержащие На 3-СААТ 2 и ТАТА-блоки, лигировали в прямой ориентации в -кассету, не содержащую промотора рВ 1101.1. Фрагменты, которые не содержали На 3-А-ТАТА-блок, лигировали в обеих ориентациях выше усеченного промотора 35 рВ 1120. Эти фрагменты субклонировали в соответствующую -кассету. Полученные конструкции обозначали в соответствии с их концевыми сайтами, причем последующая букваозначает прямую ориентацию, а буква- обратную ориентацию. Стрелками показана ориентация фрагмента по отношению к кодирующей области(фиг. 4). На 3-/-конструкции содержат 404 п.о.фрагмент (-) в обеих ориентациях нормальнойи обратной . Точность и ориентация каждой конструкции была подтверждена с помощью двухнитевого дидезоксисеквенирования (С и,). Трансформация растений Плазмидные конструкции на основе В-19 использовали для трансформации табака (. х) в соответствии со стандартными процедурами ( и др., 1985) за исключением того, что исходные трансформанты подвергали селекции на 50 мкг канамицина/мл, а затем переносили на 100 мкг/мл канамицина. Растения подвергали самоопылению, семена проращивали на канамицине(400 г/мл) для идентификации трансформантов, поскольку конструкции на основе В-19 содержат ген неомицинфосфотрансферазы (РТ 11), который сообщает резистентность к токсичному антибиотику канамицину. Число копий каждой -конструкции,интегрированной в геном табака, оценивали для каждого трансформанта путем определения частоты сегрегации гена РТ 11. Большинство трансформан 10 тов содержало лишь один локус сегрегации конструкции. Дочерние гомозиготные растения использовались там, где это указано. Трансгенные растения,представляющие все испытуемые конструкции, были получены для всех случаев, за исключением обратной конструкции Н-2. Трансгенные растения выдерживали в камерах Конвирона с циклом деньночь 16 ч 8 ч, температурой 24 С, относительной влажностью 70-80 . Для предупреждения десикации до проведения испытаний придерживались строгого режима орошения растений. Таблица 1 Конструирование Описание Родительские плазмиды рВ 1101.1 Кассета репортерных генов, не содержащая промотор и полученная на основе В-19. рВ 1121.1 Промотор 35 , сшитый с -кассетой в рВ 1101.1. рВ 1120 Промотор 35 , усеченный у ЕсоР-сайте с сохранением СААТ- и ТАТА-блоков и сшитый с -кодирующей областью. рНа 32,8 2,8 кв - Ва 1- 1-фрагмент На 3 в р содержит 2,4 кв выше от кодирующей области На 3-А и 0,38 кв ниже от сайта инициации транскрипции был использован для создания экзонуклеазных 111 делеций. рНа 3-А-2,4 2,4 кв - На 3-фрагмент, полученный в результате 3 переваривания экзонуклеазой 111 рНа 3 А-2,8 - 24 содержит СААТ и ТАТА-блоки На 3-А. рНа 3-А-2,3 2,3 кв - На 3-А-фрагмент, генерированный в результате переваривания экзонуклеазой 111 рНа 3 А-2,8 - (-75) содержит СААТ-блок На 3-А. Производные конструкции На 3-А 2,4 кв-вставка рНа 3 А-2,4, лигированная с рВ 1101.1 в прямой ориентации. На 3-А-Н/0,85-кв-ВаН 1-11-фрагмент/ от рНа 3 А-2,3, клонированный в прямой и обратной ориентации по отношению к усеченному промотору 35 рВ 11120. На 3-А-Н/ 0,85 кв-фрагмент, вырезанный как -фрагмент из На 3 АН/ и клонированный в обратной ориентации по отношению к усеченному промотору 35 рВ 1120. На 3-А-НВ/1,6 кв-ВаН 1-Ва 11-фрагмент из рНа 3 А-2,3, клонированный в прямой и обратной ориентациях по отношению к усеченному СаМ-промотору 35 рВ 1120. 0,6 кв-11-Ва 11-фрагмент из На 3-А, клонированный в прямой и обратной ориентации по отношению к усеченному СаМ-промотору 35 рВ 1120 и сконструированный путем делеции 11-1-фрагмен-та из На 3-А-НВ/ и На 3-АНВ/ соответственно. 1,4 кв 11-фрагмент из рНа 3-А-2,3, клонированный в прямой и обратной ориентации по отношению к усеченному СаМ-промотору 35 в рВ 1120. 0,66 кв-Ва 11-11-фрагмент из рНа 3-А-2,3, клонированный в прямой и обратной ориентации по отношению к усеченному СаМ-промотору 35 в рВ 1120. 2,3 кв-вставка из рНа 3-А-2,3,клонированная в прямой ориентации по отношению к усеченному СаМ-35 рВ 1120. 1,5 кв 11-фрагмент из рНа 3-А-2,4, клонированный в прямой ориентации по отношению к рВ 1101.1 0,4 кв-11-Нра 1-фрагмент из На 3-, клонированный в прямой и обратной ориентации по отношению к усеченному СаМ-промотору 35 в рВ 1120.-активность определяли в эмбриональных и неэмбриональных тканях трансгенных растений табака, содержащих каждую из конструкций, описанных в табл. 1. При этом были использованы стандартные процедурыи др. (1987). Растительную ткань измельчали в экстрационном буфере (50 мМ, 4, 10 мМ ЭДТК, 0,1, 0,1 Тритон Х-100 и 10 мМ меркаптоэтанола). После центрифугирования лизата супернатант удаляли в свежую пробирку и распределяли на 100 мкл аликвоты. Затем в экстракционный буфер добавляли равный объем 2 мМ 4 метилумбеллиферилглюкуронида и инкубиро вали в течение 1 часа при 37 С. После этого реакцию прекращали путем добавления 0,8 мл 23(0,2 М). Флуоресценцию полученного 4 метилумбеллиферона (4-МУ) определяли с помощью минифлуоритметраТКО-100, как описано ( и др., 1987). -активность выражали в пикомолях 4-МУ на единицу массы всего образца белка в минуту. На -активность оценивали семядоли, гипокотили, листья и корни от трансгенных проростков от 18 до 20 дней после набухания (ДПН), содержащих различные элементы последовательности На 3-А(систематизированные на фиг. 4), которые индуцируют -экспрессию. Результаты представлены в табл. 2. Все конструкции, содержащие некоторую частьот генов На 3-А и На 3- гелиантинина, продуцировали -активность в семенах трансгенного табака. Полная регуляторная область и фрагменты, происходящие от этой области, а также На 3-/-конструкции, все индуцировали значительную -активность в зрелых семенах по сравнению -экспрессией, индуцированной интактным СаМ-35-промототным комплексом(рВ 1121). Однако хорошо выраженная семяспецифическая экспрессия была получена лишь с использованием конструкций, содержащих 5 проксимальные области между -75 и 24 (см.и-2377 - 24 или -1527 - 24, демонстрировали тканеспецифическую -экспрессию с необнаруживаемой -активностью во всех тканях трансгенных проростков. Однако уровень экспрессии конструкции в зрелых зернах в шесть раз превышает уровень экспрессии -1. Для сравнения, активность в тканях проростков, содержащих интактный СаМ-35-промоторный комплекс(рВ 1121), используется так же, как негативный контроль содержащие усеченный СаМ-35-промотор(рВ 1120) или не содержащие промотор (рВ 1101). По сравнению с экспрессией в семенах, в листьях, содержащих ту же самую конструкцию, наблюдалась незначительная экспрессия но, с другой стороны,большинство конструкций (кромеи -1) обнаруживали значительную экспрессию в трансгенных проростках. В соматических тканях, за исключением корней,полная активность, индуцированная интактным СаМ-35-промоторным комплексом, превышает активность, индуцированную другими конструкциями. В частности, уровни -активности в корнях проростков, содержащих конструкции НВ/ (-2377-739) и / (-1527 - -739), в 7-8 раз превышают уровни -экспрессии в корнях под контролем интактного промотора 35 . 8474 Таблица 2 Суммарная оценка -экспрессии в эмбриональных и неэмбриональных тканях трансгенных растений табака Конструкция Таблица 2 (продолжение) 1. Зрелые семена и ткани саженцев трансгенных растений табака, содержащих конструкции, изображенные на фиг. 1, анализировали на активность. 2. Конструкции показаны на фиг. 1. Прямаяи обратная , нормальнаяи обращенная (1) ориентация каждого фрагмента гелиантинина дана по отношению к усеченному промотору 35 . 3. Развивающиеся зерна трансгенного табака, содержащего прямые конструкции, изображенные на фиг. 1, анализировали на -активность от 8 до 24 ДПЦ с интервалом приблизительно в два дня. Профили типа 1, 11 и 11 определены в примере 3. 4. Н/о - не определяли в этой серии экспериментов. 5. Во всех экспериментах -активности представляют собой средние значения по 4-10 независимо трансформированным растениям для каждой конструкции. Были внесены поправки на ср. кв. погрешности. 6. -активность в зрелых (30 ДПЦ) семенах трансгенного табака. 7. Трансгенные проростки табака аксенически культивировали на твердой среде. Ткани от проростков (18-20 ДПН) собирали и анализировали на активность. 8.АВА-восприимчивость наблюдалась только в развивающихся семенах 12-18 ДПЦ (см. текст и табл. 3). Для всех других конструкций АВА-ответ предварительно определяли по -экспресии вы 12 сушенных листьев с последующей иллюстрацией того, что проростки указанных растений реагируют непосредственно на экзогенную АВА. Знакозначает индуцирование -активности сверх базального уровня. Знак - означает отсутствие активности. Пример 3 Биохимическое обнаружение -активности экспрессия, регулируемая в процессе развития Определяли временной профиль, сообщаемый каждой прямой конструкцией, и результаты этого определения представлены в табл. 2. Дочерние гомозиготные растения культивировали, доводили до цветения, и семена из стручков на соответствующих стадиях анализировали на -экспрессию, как описано в примере 2. Исходя из времени начального выявления -активности в развивающихся эмбрионах и количественных и качественных характеристик полученных картин экспрессии, были идентифицированы три типа профилей развития. Профили типа 1 обнаруживают правильную временную регуляцию, где аккумуляция -начинается через 12 дней после цветения (ДПЦ). В растениях, обнаруживающих профили типа 11, -активность также начинает аккумулироваться примерно через 12 ДПЦ, но достигает пика примерно через 14 ДПЦ,а затем уровни -активности значительно снижаются. Растения типа 111 обнаруживают активность ранее, чем через 10 дней после цветения ДПЦ, при этом пик активности достигается приблизительно через 12 ДПЦ. Этот более ранний времен 8474 ной профиль сообщают конструкции, содержащие области 3-, соответствующие нуклеотидам -2377 -1527 или 739 -75. Пример 4 Гистохимическая локализация -активности Гистохимическое определение локализации активности осуществляли для проростков, содержащих На 3/ и 3404. Образцы промывали в 50 мМ 4 и инкубировали 24 часа при 37 С в 100 мкл реакционного буфера 50 мМ 4, рН 7,0, 2 мМ 5-бром-4-хлор-3-индолилглюкуродида (х-с), 0,1 мМ железосинеродистого калия и 0,1 мМ железосинеродистого калия. Затем образцы наносили на предметные стекла микроскопа с 80 глицерина. Проростки с На 3404 (фиг. 7 А) и На 3-/ (фиг. 7 В), культивированные на базальных средах, содержащих 1 сахарозы, обнаруживали различный характер экспрессии. На 3 индуцированная -экспрессия обнаруживалась на низких уровнях в семядолях и на значительно более высоких уровнях в дистальных областях корней при этом активность вообще отсутствовала в гипокотилях. На 3/-проростки также обнаруживали значительную -активность в дистальных отделах корней и не обнаруживали активности в гипокотиле или семядолях. -активность гистохимически обнаруживалась на 14 день после цветения в саженцах, содержащих На 3404, которые были культивированы в условиях водного дефицита окружающей среды на фильтровальной бумаге с неполным насыщением при этом -активность наблюдалась главным образом в листьях и корнях указанных саженцев (фиг. 7 С). Определяли характер -экспрессии саженцев,содержащих На 3/. Главная область активности в /-саженцах наблюдалась в кончиках развивающихся корней (фиг. 7 В, С). В 6 ДПЦсаженцах, содержащих На 3/,экспрессировалась по всей длине удлиняющегося корня,причем максимальные уровни наблюдались в меристематической области верхушек корней (фиг. 71). Гистохимическая оценка -активности в На 3-/-саженцах (14 ДПЦ) показала наличие активности во вновь образованных боковых корнях, а также сохраненную активность в меристематической области главного корня (фиг. 7 В). Проростки от 16 ДПЦ показывали ту же картину экспрессии (фиг. 7 С) также высокая -активность наблюдалась в корневых волосках и дистальных областях корней. Пример 5 АВА-восприимчивая экспрессия В серии экспериментов, проведенных на трансгенных растениях табака, содержащих конструкции,показанные на фиг. 4, было идентифицировано несколько -областей На 3- и 3-, которые оказались восприимчивыми к изменению в растениях водного потенциала (табл. 2). Поскольку АВА,как известно, является медиатором ответа на водный дефицит, то определяли действие АВА наэкспрессию, индуцированную указанными элементами. В На 3- были обнаружены две области(нуклеотиды от -1527 до -739 и от -739 до -75), которые индуцируют АВА-восприимчивую экспрессию в листьях зрелого трансгенного табака и в саженцах. Другой АВА-чувствительный элемент был идентифицирован в 3- (от -739 до -322). Корреляция -активности в трансгенном табаке, содержащем На 3404 (прямая ориентация) с водным потенциалом, наблюдалась в течение прогрессирующей десикации и при последующем выводе из водного стресса. Поскольку На 3- с полной длиной не экспрессируются ни при каких условиях, за исключением периода развития семени,то растения, содержащие эти химерные конструкции, использовали в качестве негативного контроля. Дочерние гомозиготные растения, содержащие каждую конструкцию, выращивали в почве. Эти растения либо нормально поливали (контроль),либо содержали в условиях водного стресса, варьируя степень орошения от 1/3 количества воды, используемого для контрольного растения, вплоть до полного отказа от полива. Растения, содержащие На 3404 и находящиеся в полном водном стрессе, быстро, примерно за 36 часов, индуцировали пик -активности, который коррелировал со снижением водного потенциала (фиг. 8). Последующее определение -активности через 24 часа выявило воспроизводимое снижение активности, даже если растения продолжали находиться в условиях жесткого водного стресса с водным потенциалом,близким к 4 бар. Растения в условиях полного водного стресса восстанавливали путем орошения на 3-й день после завершения взятия проб. После орошения растения быстро восстанавливали водный потенциал, который возвращался до своего дострессового уровня, а -активность продолжала снижаться в течение всех последующих дней. В растениях, находящихся в 1/3 стрессовых условиях (см. выше) и содержащих На 3,-активность медленно увеличивалась в течение 3,5 дней по мере уменьшения водного потенциала (фиг. 8). Как и в случае растений в условиях полного стресса, активность начинала снижаться до восстановления водного дефицита. При этом не наблюдалось ни одного случая, когда -растения экспрессировалив неэмбриональных тканях. Для того, чтобы определить, является ли 404 п.о. - фрагмент из На 3- чувствительным к непосредственному воздействию АВА, листовые диски трансгенного табака, содержащего На 3404,обрабатывали АВА в течение увеличивающихся периодов времени, после чего эти диски анализировали на -экспрессию. После лаг-периода, составляющего приблизительно 3,5 часа, обработка 10 мМ АВА давала быстрое увеличение экспрессии аккумуляцияпродолжалась на протяжении 8 часов, а после этого скорость аккумуляциизначительно снижалась (фиг. 9). При этом 8474 тех же растений, содержащихся в идентичных условиях, за исключением обработки АВА. Аналогичным образом листовые диски растений, содержащих 3- с полной длиной, не обнаруживали никакой активности на протяжении всего эксперимента. Поскольку химерный ген, содержащий СаМ-35-промотор и репортерный ген глюкуронидазы, является транскрипционально активным в листьях (табл. 1), то трансгенные растения, содержащие рВ 1121, использовали в качестве важного негативного контроля. Листовые диски растений, содержащих рВ 1121, не показывали увеличения -активности в ответ на воздействие экзогенной АВА на протяжении всего эксперимента(АВА 12,63,3 пмоль 4-МУ/мкг/мин -АВА 13,53,6 пмоль 4-МУ/мкг/мин). Аналогичная серия экспериментов была проведена с трансгенными саженцами табака, содержащими На 3404 и 3 (фиг. 4). Саженцы 18 ДПН переносили на среды, содержащие 010 мМ АВА, и определяли -активность на 1-й,2-й и 3-й день (табл. 3). Саженцы, содержащие На 3404, были восприимчивы к воздействию АВА на 1-й день при всех концентрациях АВА тогда как в параллельных экспериментах На 3 саженцы не показали значительной индукции. Индукция зависит от времени и концентрации. Максимальная индукция (200-кратная) имела место на 2-й и 3-й дни при концентрации АВА 10 мМ (табл. 3). Значительная индукция 19- и 70-кратная) наблюдалась на 3-й день при 0,1 мМ и 1,0 мМ АВА соответственно.3- гелиантинина с полной длиной(от -2377 до 24) испытывали на их АВАиндуцибельность в развивающихся семенах. Семена, содержащие регуляторную область с полной длиной , индуцирующую -экспрессию (фиг. 4), доводили до стадии 11, 14, 18 и 24 дня после цветения (ДПЦ) и анализировали на их способность к ответу на воздействие АВА. АВА-индукция обнаруживалась посредством увеличения уровней активности по отношению к уровням, полученным на базальной среде. Полученные результаты систематизированы в табл. 3. АВА-восприимчивость варьировалась в зависимости от стадии развития. Семена от 11 ДПЦ не реагировали на АВА на протяжении всего эксперимента, тогда как более зрелые семена обнаруживали чувствительность к воздействию АВА. Семена от 14 ДПЦ показывали быстрый ответ, начиная уже с 1,5 часов, с уровнем индукции,превышающим базальные уровни. Для 14 ДПЦсемян, обработанных АВА, эти уровни активности монотонно увеличивались, и на 3-й день после обработки они были выше, чем уровни для 18 ДПЦ- и 24 ДПЦ-семян, обработанных или не обработанных АВА. 18 ДПЦ-семена давали более медленный ответ на АВА, чем 14 ДПЦ-семена, однако их уровни -активности достигали значений,сравнимых с уровнями для 14 ДПЦ- (АВА)-семян,лишь на 5-й день после АВА-обработки. 24 ДПЦ 14 семена были менее восприимчивы к АВА через 5 дней после АВА-обработки. Уровни активности также варьировали в зависимости от того, были ли семена инкубированы лишь на одной базальной среде. 14 ДПЦ-семена на базальной среде обнаруживали постепенное увеличение активности, оцененной в 4 пМ 4-МУ/семя/день. Полученные результаты проиллюстрировали иерархический принцип регулирования экспрессии гена гелиантинина, заключающийся в том, что АВАчувствительные элементы, содержащиеся в На 3, функционируют только в условиях соответствующей программы развития. Если АВАчувствительные элементы удалить из их соответствующего окружения в На 3 или 3, то это приведет к потере иерархического контроля таким образом, что эти элементы будут свободно реагировать на прямое воздействие АВА и косвенно на десикацию в листьях и проростках трансгенного табака. Таблица 3 АВА-индукция 3 в трансгенных семенах табака Трансгенные семена табака, содержащие На 3-, были собраны в указанные дни после цветения (ДПЦ) и инкубированы на лишь одной базальной среде или на базальной среде, содержащей 1 мкМ АВА. -активность определяли через 0, 3 и 5 дней после обработки. Для сравнения приводятся данныео-экспрессии , индуцированной На 3, в развивающихся семенах (нормальные). Пример 6. Введение признака резистентности к гербициду в растение табака 0,66 кв-Ва 11-11-фрагмент из родительской плазмиды рН 32,3 (табл. 1) сшивали его 5 концом с 111-сайтом, а его 3-концом с Есо 1 сайтом. Полученную кассету использовали для замены области двойного СаМ-промотора в р-410-конструкции (описанной во французской патентной заявке 91 02872 от 5 марта 1991) путем переваривания указанной конструкции 111 и 8474 Есо 1 и субклонирования этой кассеты в вектор. Полученная конструкция, обозначенная р-803, содержала в транскрипционной рамке следующие элементы регуляторный элемент гелиантинина оптимизированный транзитный пептид (ОТП), аоАген, -терминатор. Плазмиду р 803 переносили в штамм ЕНА 101( и др.(1986) . , 168, 1291) посредством тройного скрещивания, и полученнуюиспользовали для трансформации дисков листьев табака. Регенерированные растения табака, высотой примерно 20 сантиметров, опрыскивали в условиях теплицы глифосатом в виде препаратав дозе 0,6 кг активного ингредиента на гектар. При обработке указанной дозой глифосата нетрансформированные контрольные растения погибали. В противоположность этому трансформированные растения оставались невредимимы и жизнеспособными,что свидетельствовало об их толерантности к глифосату. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенная нуклеиновая кислота гена гелиантинина, включающая, по крайней мере, один регуляторный элемент, который контролирует, по крайней мере, один из типов экспрессии, а именно экспрессию семяспецифичных генов, экспрессию корнеспецифичных генов, экспрессию, зависимую от абсцизовой кислоты (АВА) и зависимую от времени экспрессию генов. 2. Нуклеиновая кислота по п. 1, отличающаяся тем, что регуляторный элемент, контролирующий экспрессию, зависимую от АВА, характеризуется тем, что экспрессия генов под его контролем обнаруживается в ответ на обработку АВА или в условиях индукции синтеза АВА. 3. Нуклеиновая кислота по п. 1, отличающаяся тем, что регуляторный элемент, контролирующий зависимую от времени экспрессию генов, характеризуется тем, что экспрессия генов под его контролем обнаруживается в семенах растений 4 дня спустя после цветения. 4 .Нуклеиновая кислота по п. 1, отличающаяся тем, что регуляторный элемент контролирует семяспецифичную экспрессию генов и включает нуклеотиды 851-2401 или 1-2401 последовательности 1. 5. Нуклеиновая кислота по п. 1, отличающаяся тем, что регуляторный элемент контролирует корнеспецифичную экспрессию и включает нуклеотиды 1-1639 или 851-1639 последовательности 1. 6. Нуклеиновая кислота по п. 1 или 2, отличающаяся тем, что регуляторный элемент контролирует экспрессию, зависимую от АВА, и включает нуклеотиды 1-2401 последовательности 1,нуклеотиды 851-16391, нуклеотиды 1639-23031 или нуклеотиды 1-4043. 7. Нуклеиновая кислота по п. 1 или 3, отличающаяся тем, что регуляторный элемент контролирует зависимую от времени экспрессию генов и включает нуклеотиды 1-851 или 1639-23031. 8. Химерный ген растений, содержащий 5 фланкирующую область, оперативно связанную с кодирующей последовательностью гетерологичного гена, отличающийся тем, что названная кодирующая последовательность оперативно связана с 3 сайтом полиаденилирования и где названная 5 фланкирующая область содержит регуляторный элемент по любому из пунктов 1-7. 9. Химерный ген растений по п. 8, отличающийся тем, что регуляторный элемент включает нуклеотиды 851-2401 или 1-24011. 10. Химерный ген растений по п. 8 или 9, отличающийся тем, что содержит промотор, который функционирует в растении, причем указанный промотор операбельно связан 5-концом с указанной кодирующей последовательностью и 3- концом - с регуляторным элементом. 11. Химерный ген по п. 10, отличающийся тем, что промотор является промотором вируса растений или промотором вируса мозаики цветной капусты. 12. Вектор трансформации растений, отличающийся тем, что содержит химерный ген растений по любому из пп. 8-11. 13. Клетка растений, содержащая химерный ген растений по пп. 8 или 9. 14. Способ получения растения, резистентного к гербициду, отличающийся тем, что осуществляют а) трансформацию растительной клетки вектором трансформации по п. 12 и б) регенерацию указанного растения из трансформированной клетки.
МПК / Метки
МПК: C12N 5/10
Метки: выделенная, гелиантинина, гербициду, растения, получения, нуклеиновая, растений, способ, ген, клетка, кислота, гена, резистентного, трансформации, химерный, вектор
Код ссылки
<a href="https://kz.patents.su/26-8474-vydelennaya-nukleinovaya-kislota-gena-geliantinina-himernyjj-gen-rastenijj-vektor-transformacii-rastenijj-kletka-rastenijj-sposob-polucheniya-rasteniya-rezistentnogo-k-gerbicidu.html" rel="bookmark" title="База патентов Казахстана">Выделенная нуклеиновая кислота гена гелиантинина, химерный ген растений, вектор трансформации растений, клетка растений, способ получения растения, резистентного к гербициду</a>
Предыдущий патент: Способ очистки нефти и газоконденсата от низкомолекулярных меркаптанов
Следующий патент: Подвесное устройство для обработки пятника железнодорожного вагона
Случайный патент: Способ извлечения благородных металлов из щелочных цианистых растворов