Вакцинная композиция против гепатита, способ профилактики гепатита
Номер патента: 9662
Опубликовано: 15.11.2000
Авторы: Клотильда Тирьяр, Натали Мари-Жозеф Клод Гаркон-Жонсон, Пьер Вёт, Пьер Озер
Формула / Реферат
Состав вакцины для лечения или профилактики инфекционного гепатита, особенно гепатита В, содержащий антиген гепатита и соответствующий носитель, такой как квасцы, в сочетании с 3-О-деацилированным монофосфорил липидом А. Описаны также ассоциированные вакцины, включающие состав вакцины данного изобретения.
Текст
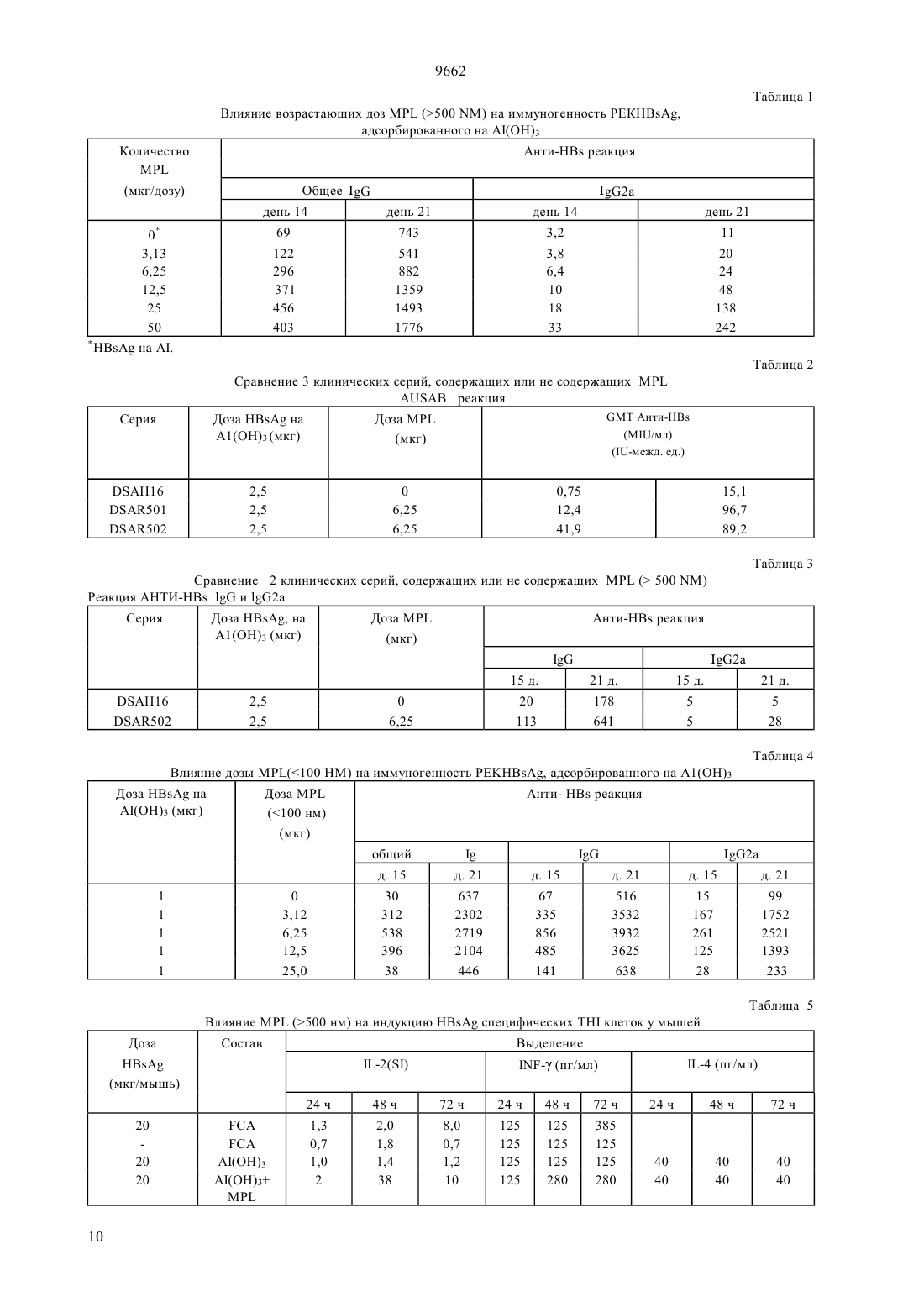
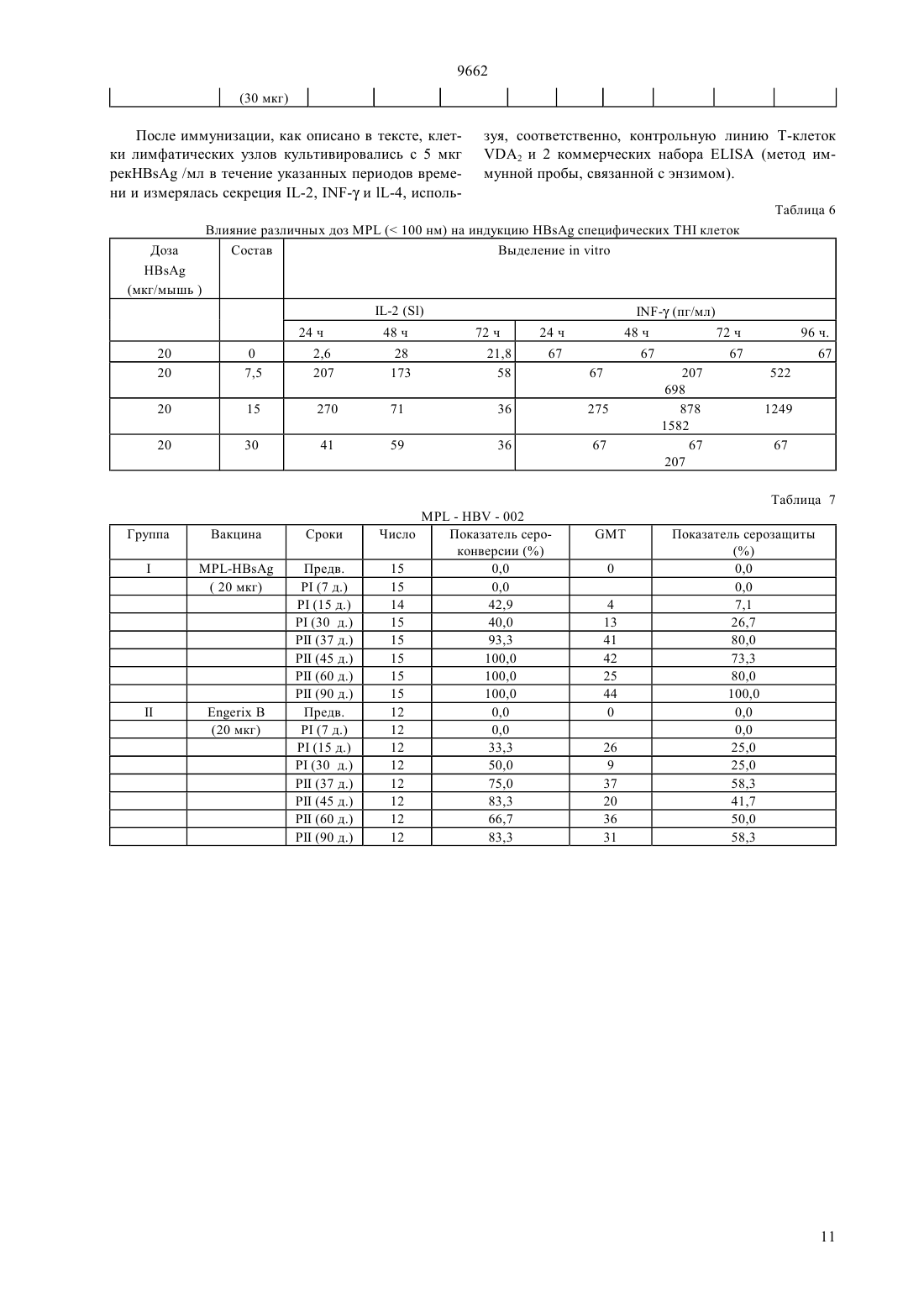
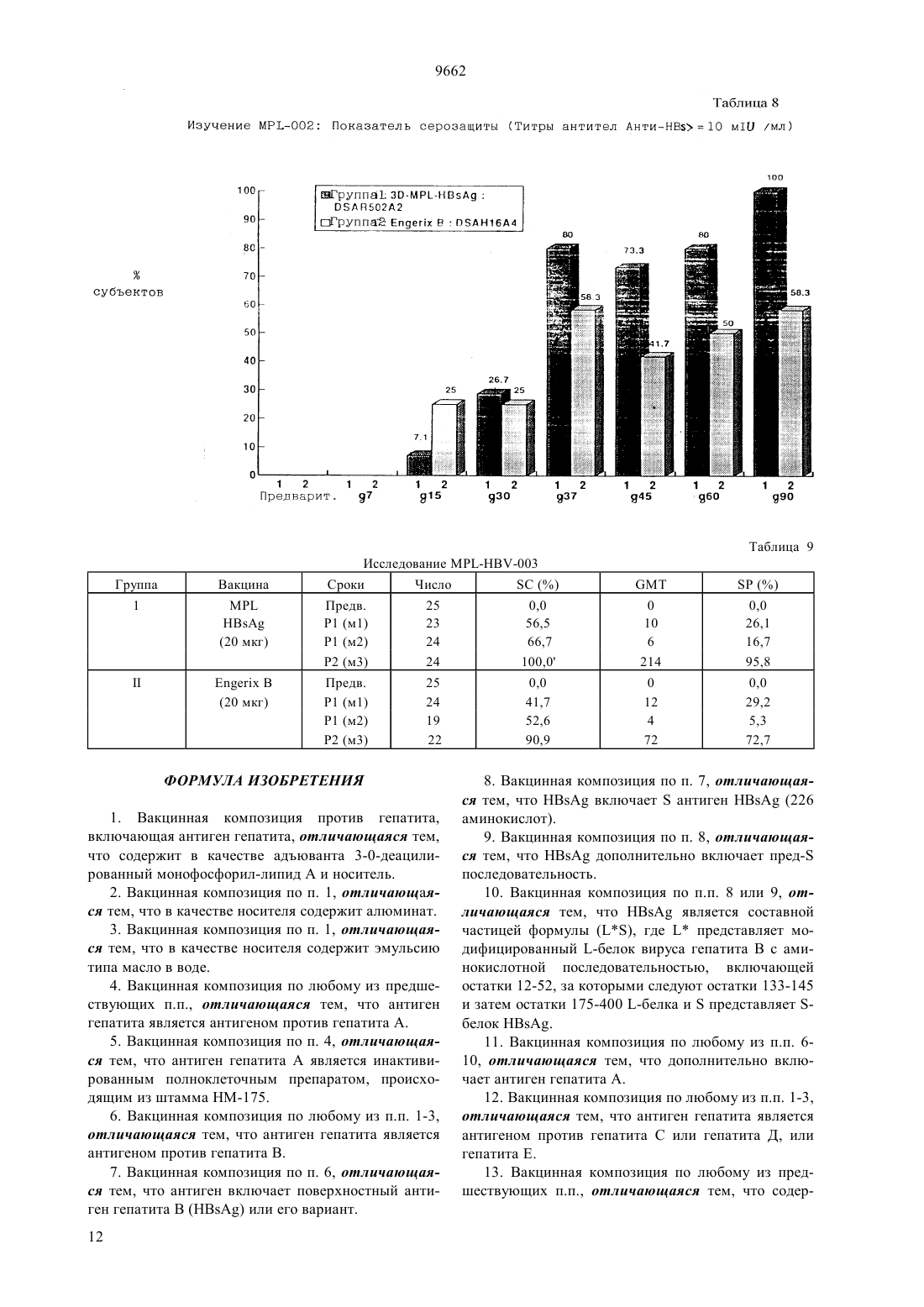
(51)6 61 35/78, 61 39/32, 61 39/39 НАЦИОНАЛЬНОЕ ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(73) Смитклайн Бичэм Байолоджикалс С.А.(54) ВАКЦИННАЯ КОМПОЗИЦИЯ ПРОТИВ ГЕПАТИТА, СПОСОБ ПРОФИЛАКТИКИ ГЕПАТИТА(57) Состав вакцины для лечения или профилактики инфекционного гепатита, особенно гепатита В, содержащий антиген гепатита и соответствующий носитель, такой как квасцы, в сочетании с 3-Одеацилированным монофосфорил липидом А. Описаны также ассоциированные вакцины, включающие состав вакцины данного изобретения. 9662 Настоящее изобретение относится к составам новой вакцины, методам их приготовления и их использования в терапии. В частности, настоящее изобретение относится к новым составам для лечения инфекций гепатита и к составам комбинированной вакцины, включающим в качестве компонента вакцину гепатита. Вирусный гепатит, вызванный вирусами гепатита А, В, С,и Е, является очень распространнным вирусным заболеванием. Через вирусы В и С, в частности, он ответственный за многие случаи рака печени. Так что разработка эффективных вакцин имеет решающее значение и, несмотря на значительные успехи, до сих пор является актуальной задачей. Обзор современных вакцин против гепатита,включая большое число основных ссылок, можно найти в журналеза 12 мая 1990 г. на странице 1142 (Проф. ). См. также Вирусный гепатит и болезнь печени (, . . и , . ., изд., . (1984) и Вирусный гепатит и болезнь печени (Труды Международного симпозиума, 1990,изд. . . , .,опубликованных). Как принято здесь, выражение антиген гепатита используется для указания на любой антигенный материал, полученный из вируса гепатита, который может быть применен для стимулирования иммунитета к вирусу у людей. Антиген гепатита может быть, например, полипептидом, полученным с помощью метода рекомбинации ДНК, или ослабленным штаммом вируса гепатита, который по выбору был инактивирован известными методами. Изобретение распространяется на все антигены гепатита,любого из гепатита , , ,или , примеры которых рассматриваются ниже. Инфекция вирусом гепатитаявляется широко распространнной проблемой, но имеются вакцины, которые могут быть использованы для массовой иммунизации, к примеру продукт, который является убитой ослабленной вакциной, полученной из штамма НМ-175 вируса гепатита(см. Инактивированные кандидат. вакцины для гепатита А, авторов , А.Н и .,. . . т. 37, с. 72-95 (1990) и монографию о продуктах , опубликованную( 1991. Флемигг и др. (а 1) (в цитируемом месте с. 56-71) сделал обзор клинических аспектов,вирусологии, иммунологии и эпидемологии гепатита А и рассмотрел подходы к разработке вакцин против этой распространнной вирусной инфекции. Как принято при см, выражение антигенотносится к любому антигену, способному к стимулированию нейтрализующего антитела ку человека. Антиген НА может содержать живые ослабленные вирусные частицы, или инактивированные ослабленные вирусные частицы, или быть может, например, белковую капсулу , или вирус 2 ный протеин , которые могут быть по общепринятой технологии рекомбинации ДНК. Инфекция вирусом гепатита Вявляется широко распространенной проблемой, но сейчас имеются вакцины, которые могут быть использованы для массовой иммунизации, например, продукт- ( ), который получен методом генной инженерии. Приготовление поверхностного антигена гепатита Вхорошо задокументировано. См., например,и др. в . .54,с. 125 (1983), ( и др. в , 5, с. 479(1987), 0 226 846, 0 299 108 и ссылки к ним. Как принято, выражение поверхностный антиген гепатита В иливключает любой антигенили фрагмент от него, проявляющий антигенные свойства поверхностного антигена . Следует понимать, что в дополнение к 226 последовательности аминокислоты антигена(см.и др., ж. , 317, 489 (1985) и ссылки к нему),описанный при см , если желательно, содержит полную или часть предпоследовательности,как описано в указанных выше ссылках и в ЕР-А- 0 278 940. В частности,может содержать полипептид, включающий последовательность аминокислоты, включающую остатки 12-52, сопровождаемые остатками 133-145, сопровождаемые остатками 175-400 -протеина , связанного с открытым каркасом на вирусе гепатита В серотипа(этот полипептид упомянут как х см. ЕР 0 414 374). В пределах действия изобретенияможет также включать предпред 2 - полипептид,описанный в ЕР-0 198 474 (.) или его аналоги, такие, как описанные в ЕР 0 304 578 (с. С). , как описано здесь, может также относиться к мутантам, например, устойчивому мутанту, описанному в 91/14703 или в Публикации применения Европейских патентов 0 511855 А 1, особенно , в аминокислоте которого в позиции 145 глицин замешен на аргинин. Обычнопредставлен в виде частиц. Частицы могут содержать, например, толькопротеин или могут представлять собой составные частицы,например, (, ), гдеявляется частицей, указанной выше, иобозначает -протеин . Указанная частица наиболее удобна в виде, в котором она представлена в дрожжах. Вирус гепатита Сспециально рассмотрен в 2 212 511 В и в ссылках к нему. Сообщалось,что вакцины могут быть приготовлены из одного или более иммуногенных пептидов, произведенных из Н ДНК. Вирусгепатита рассматривается в Вирусный гепатит и болезнь печени (Симпозиум, 1990, цитированном выше). Вирус Е гепатита (НЕ) специально рассмотрен в публикации 89/12462 и ссылках к нему. Пример состава вакцины включает, в фармацевтически 9662 приемлемой добавке (адъюванте), рекомбинированный протеин или смесь протеинов, произведенных из НЕ. В то время как экспериментальные и имеющиеся в коммерческой продаже вакцины против гепатита,например,и -, дают замечательные результаты, признанным фактом является, что оптимальная вакцина должна стимулировать не только нейтрализующие антитела, но должна также стимулировать, как можно более эффективно, клеточный иммунитет посредством -клеток. Существует также потребность в комбинированных вакцинах, содержащих компонент гепатита, для стимулирования таким путм клеточного иммунитета. Настоящее изобретение достигает этой цели. Настоящее изобретение обеспечивает получение вакцины, содержащей антиген гепатита в соединении с 3-0-деацилированным монофосфорил липидом А (сокращено здесь МР), и подходящий носитель. 3-0-деацилированный монофосфорил липид А(или 3-Де-0-ацилированный монофосфорил липид А) прежде назывался 3- или 3- для указания, что позиция 3 восстанавливающего концевого глюкозамина является де-0-ацилированной. Приготовление, см. патент Великобритании 2 220 211. Химически это смесь 3-деацилированного монофосфорил липида А с 4, 5 или 6 ацилированными цепями. Здесь обозначение 3- (или 3-Р) сокращено до , поскольку МР вляется зарегистрированной торговой маркой Риби Иммунохем,Монтана ( ., Моаа), которая используется фирмой Риби для недвусмысленного обозначения своего продукта 3-0-деацилированного монофосфорил липида А. В источнике 2 220 211 упоминается, что эндотоксичность используемых прежде энтеробактериальных липополисахаридовснижается при сохранении иммуногенных свойств. Тем не менее в источнике 2 220 211 цитируется эти данные только в связи с бактериальными (грамнегативными) системами. К дате приоритета настоящего изобретения пригодность 3 деацилированного монофосфорил липида А в качестве адъюванта для вакцины, содержащей вирусный антиген гепатита, не отмечалась. Тем не менее,неожиданно, было обнаружено, что составы вакцины, в соответствии с изобретением, содержащие вирусные антигены гепатита, обладают особенно выгодными свойствами, как описано ниже. Особым преимуществом является то, что составы вакцины изобретения являются очень эффективными в стимулировании защитного иммунитета, даже с очень малыми дозами антигена. Они обеспечивают превосходную защиту против первичной инфекции и стимулируют благоприятно иммунные реакции как специфически гуморальную(нейтрализующие антитела), так и посредством эффекторных клеток . Дальнейшим важным преимуществом является то, что составы вакцины, согласно изобретению, могут также быть использованы в качестве терапевтических вакцин., как определено выше, будет нормально присутствовать в пределах 10-100 едг, преимущественно 25-50 едг на дозу, в которой антиген гепатита будет типично присутствовать в пределах 2-50 едг на дозу. Носителем может быть эмульсия масла в воде,липидный растворитель, или квасцы (соль алюминия). Эмульсии нетоксичного масла в воде предпочтительно содержат нетоксичное масло, например,сквален и эмульгатор такой, как Твин 80 в водяном носителе. Водяной носитель может быть,например, буферный раствор фосфата. Одним воплощением изобретения является антиген НА (например, как в Нах ) в примеси с МР и алюминий гидроксидом, как описано ниже. Дальнейшим воплощением изобретения являетсяантиген (например, как в -) в примеси с МР и люминий гидроксидом, как описано ниже. Дальнейшим воплощением изобретения является В антиген как (,) частицы, определнный при сем выше, в примеси си алюминий гидроксидом. В указанных выше воплощениях эмульсия масла в воде может быть использовала вместо квасцов. Другие воплощения даны в приведенных ниже примерах. В дальнейшем аспекте изобретение предусматривает состав вакцины, как описан ниже, для использования в медицинской терапии, в частности, для применения при лечении или профилактики вирусных инфекций гепатита. В предпочтительном аспекте вакцина, согласно изобретению, является терапевтической вакциной, полезной для лечения застойных инфекций гепатита, особенно гепатита В и/или гепатита С у людей, страдающих от этих болезней. Принимая во внимание удивительно эффективные полученные результаты, в дальнейшем предпочтительном аспекте изобретение предусматривает состав вакцины для лечения или профилактики гепатита А и/или гепатита В при инфекциях. Преимуществом является то, что состав вакцины против гепатита, согласно изобретению, содержит другие антигены, так что она является эффективной при лечении или профилактике одной или более других бактериальных, вирусных или грибковых инфекций. Таким образом, состав вакцины против гепатита,согласно изобретению, включает предпочтительно,по меньшей мере, один другой компонент, выбранный из числа негепатитных антигенов, известных в этой отрасли медицины, для обеспечения защиты против одной или более из следующих болезней дифтерии, столбняка, коклюша, инфлюэнцы гемофилии бацили полиомиелита. 9662 Вакцина, согласно изобретению, предпочтительно включает , как определено при см выше. Определнное сочетание вакцин в сфере действия изобретения включает состав комбинации вакцин АКДС (дифтерия-столбняк-коклюш)-гепатит В,состав вакцины Н-гепатит В, состав вакцины АКДСгепатит В и состав вакцины ИПВ (инактивированная полиовакцина)-АКДСгепатит В. Приведенные выше сочетания могут выгодно включать компонент, который обладает защитными свойствами против гепатита А, особенно убитый ослабленный штамм, происходящий от штамма НМ 175, наподобие присутствующего в . Подходящие компоненты для применения в таких вакцинах уже имеются в коммерческой продаже и детали могут быть получены у Всемирной организации здравоохранения. Например, компонентом ИПВ может быть инактивированная полио вакцина. Вакцина коклюша может содержать целую клетку или неклеточный продукт. Благоприятным является то, что вакцина против гепатита или комбинированная вакцина, согласно изобретению, является педиатрической вакциной. Приготовление вакцины в общих чертах описано в(Новые тенденции и усовершенствования в области вакцин),изд.и др.,, Балтимора,шт. Мэриленд США, 1978. Инкапсулирование в липосомах описано, например, Фуллертоном, патент США 4,235,877. Конъюгация (слияние) протеинов с макромолекулами изложено, например, , патент США 4,372,945 и Армором и др., патент Ш 4,474,757. Количество антигена в каждой дозе вакцины выбирается как количество, которое вызывает иммунозащитную реакцию без значительных побочных неблагоприятных действий в типичных вакцинах. Такое количество будет изменяться в зависимости от того, какие специфические иммуногены применяются. В общем случае можно ожидать, что каждая доза будет содержать 1-1000 едг суммарного иммуногена,предпочтительно 2-100 едг, наиболее предпочтительно 4-40 едг. Оптимальное количество для определенной вакцины может быть установлено стандартными исследованиями, включающими наблюдения за титрами антител и другими реакциями в субъектах. Вслед за начальной вакцинацией субъекты могут получить вторичную вакцинацию через около 4 недели. В дальнейшем аспекте настоящего изобретения предусмотрен метод производства вакцины, эффективной в предупреждении или лечении инфекции гепатита, причм метод включает смешивание антигенов гепатита, как определено при см, с носителем и МР. Используя этот метод, один или более дополнительных компонентов предпочтительно смешиваются сдля получения комбинированной вакцины, преимущественно для применения в педиатрии. Следующие примеры иллюстрируют изобретение и его преимущества. Пример 1. Состав вакцины против Гепатитабыл получен от корп.с. Алюминий гидроксид бьл получен из Суперфоса (Алгидрогель).был повторно суспендирован в воде для инъекций при концентрации, варьирующей от 0,2 до 1 мг/мл, с помощью обработки ультзвуком в водяной ванне, пока частицы достигли размера между 80 и 500 нм, измеренного методом фотокорреляционного рассеяния света. От 1 до 20 едг( -антиген, как в) в буферном растворе фосфата при 1 мг/мл) адсорбируется на 30 до 100 едг алюминий гидроксида(раствор при 10,38 А 13 мг/мл) в течение одного часа при комнатной температуре с перемешиванием. К раствору затем добавляется от 30 до 50 едг МР(раствор 1 мг/мл). Объм и осмолярность регулируются до 600 едл водой для инъекций и фосфатным буфером 5 х концентрации. Раствор инкубируется при комнатной температуре в течение 1 часа и выдерживается при 4 до использования. Созревание состава происходит во время хранения. Это представляет собой 10 доз инъекций для испытания на мышах. Подобный состав может быть приготовлен путм использования, в качестве компонента НВ,сводного (, ) антигена как изложено выше. Пример 2. Состав вакцины против гепатита Абыл получен от. Алюминий гидроксид был получен из Суперфоса (Алгидрогель).(360 до 22 на дозу) предварительно адсорбируется до 10 конечной концентрации алюминий гидроксида (0,5 мг/мл). К раствору добавляется МР (12,5 до 100 едг на дозу). Оставшийся алюминий гидроксид добавляется к раствору и оставляется на один час при комнатной температуре. Объмы регулируются с помощью фосфатного буфера (фосфат 10 мМ, аС 150 мМ) и конечный состав хранится при 4 оС до применения. Пример 3. Состав комбинированной вакцины Гепатит ВГепатит А НВ адсорбируется до 90 конечного содержания алюминий гидроксида (0,5 мг/мл) и инкубируется в течение ночи при комнатной температуре. рН регулируется до 6,2 и состав остатся на 14 дней для созревания при комнатной температуре. Антиген Гепатита А при 360 до 22 Е на дозу,в виде инактивированной производной от НМ 175 штамма (как в) предадсорбируется на 10 конечной концентрации алюминий гидроксида (0,5 мг/мл). Оставшийся алюминий гидроксид затем добавляется к раствору и оставляется на один час при комнатной температуре при перемешивании. 9662 НА, адсорбированный на алюминий гидроксиде, добавляется затем к составу . МР добавляется к раствору /В при конечной концентрации 12,5 до 100 едг на 1 мл дозу,объм регулируется до конечного объма дозы и состав хранится до использования при 4 оС. Пример 4. Комбинированные вакцины, содержащие дополнительные антигены Комбинированные вакцины, содержащие антигены АКДС, ИПВ, , коклюша неклеточные или с полными клетками, приготовляются путм добавления одного или более из желаемых антигенов к составам, описанным в примере 1, примере 2 или примере 3 выше. ПОВЫШЕНИЕ ГУМОРАЛЬНОГО ИММУНИТЕТА И СТИМУЛИРОВАНИЕ ИММУНИТЕТА,ОПОСРЕДОВАННОГО КЛЕТКАМИ, ПУТМ ИММУНИЗАЦИИ МЫШЕЙ С ПОМОЩЬЮ ,СКОМПОНОВАННОГО С АЛЮМИНИЙ ГИДРОКСИДОМ И МР. ВЛИЯНИЕ А 1(ОН)3 НА ИНДУКЦИЮ АНТИТЕЛ АНТИМыши / были иммунизированы подкожньм или внутрикожным путем рекомбинирующим, адсорбированным на А 1(ОН)3 с , как адъювантом. Мыши были иммунизированы дважды составами //, и реакция антител была измерена после первой и второй дозы. Общий(иммуноглобулин) был измерен лабораторным комплектомили ААВ (Л 6 т. Эбботт, шт. Иллинойс) и особое внимание было уделено индукции антител изотипа 2, поскольку этот изотип индуцируется главным образом секрецией интерферона. Таким образом, индукция этого изотипа косвенно отражает активацию опосредованного клетками иммунитета, а именно, активацию 1. Соотношение / было исследовано, а также изучены размеры частиц , поскольку суспензия МР в воде может дать в результате частицы 100 нм или 500 нм. ЭКСПЕРИМЕНТ . Влияние МР ( 500 нм) дозы на иммуногенность рекомб. А, адсорбированного на 3 Группы из 10 мышей / женского пола были инъецированы подкожным путм 2,5 мкг к., адсорбированным на 50 мкг А 1 (кк А(ОН)3) и возрастающими количествами(3,1 до 50 мкг)размерами частиц 500 нм. Мыши были инъецированы дважды в объме 100 мкл с интервалом 2 недели. Они были обескровлены 2 недели после первой инъекции (частичное обескровливание) и через одну неделю после вторичной вакцинации. Суммарное количество анти-НВи характерного 2 были измерены с помощью лаб. комплекта, используя рек.в качестве захватывающего (поглощающего) антигена. Титры были выражены как обратные величины разбавления, соответствующего 50 максимального значения(средняя точка разбавления). Результаты даны в табл. 1. Они указывают на возрастание обоих харак терных показателей.и 2 при увеличении доз , в частности для доз от 12,5 до 50 мкг. Результат виден и в первичном и во втором отклике и является особенно очевидным для 2 (до 20 кратного увеличения), косвенно указывая на выделение -интерферона, индуцированного иммунизацией с помощью . ЭКСПЕРИМЕНТ . Сравнение клинических партий адсорбированного кН, содержащего или не содержащего МР (500 нм) 3 клинические партии (серии) к, адсорбированного на 3, были приготовлены партия 16 не содержалаи служила в качестве контроля. Партии 501 и 502 были приготовлены аналогичным путм (20 мкг к, адсорбированного на 0,5 мг А 1 как А 1(ОН)3, но содержали 50 мкг(500 нм). Эти 3 партии были инъецированы подкожно группам из 10 мышей (200 мкл, содержащих 2,5 мкг В, 100 мкги 6,25 мкг ), дважды с двухнедельным интервалом. Мыши были обескровлены через 14 дней и 1 неделю после вторичной вакцинации. Антитела анти-НВ были замерены с помощью набора ААВ или набором(метод иммунной пробы, связанный с ферментом) или в отношенииили 2. Результаты даны в табл. 2. Они показывают, что через 2 недели после первой инъекции 2 партии, содержащие МР, индуцировали весьма существенную анти- реакцию(12,4 и 41,9 м 1/мл), в то время как партия, которая не содержала МР, индуцировала только маргинальную реакцию (0,75 м 1/мл). Количество случаев реакции также выше с(9/10 и 9/10 против 1/10 при отсутствии МР). Влияние МР подтверждено после вторичной вакцинации, поскольку титры, полученные для партий 501 и 502, примерно в 6 раз выше, чем наблюдаемые без МР. Это указывает на то, что, по крайней мере, у мышей,(500 нм) может улучшить и кинетику анти- реакции, и уровень анти- реакции. Эти результаты были подтверждены, когда показательи 2 были замерены после иммунизации на партиях 16 (без МР) и 502 (с) анти-Нтитр в 5 раз (первичный отклик) и в 3 раза (вторичный отклик) выше, когда присутствует . Для 2 реакция, влияние , даже более впечатляюще, по крайней мере, после второй дозы,указывая на предпочтительное индуцирование 2 а. Это косвенно отражает активирование иммунитета, опосредованного клетками (выделение интерферона) препаратом, содержащим . ЭКСПЕРИМЕНТ . Влияние дозы( 100 нм) на иммуногенность к, адсорбированного на А(ОН)3 Ввиду того, чтонамног легче получить путм воспроизводства как частицы 100 нм, чем частицы 500 нм, было исследовано влияние частицы 100 нм на иммуногенность рекА, адсорбированного ранее на А 1(ОН)3 5 9662 Группы из 10 мышей (Ва/, женского пола,возраст 7 недель) были инъецированы подкожно 1 мкг к, адсорбированного на 50 мкг А 1(в виде А(ОН)3) и в присутствии возрастающего количества (3,1 до 25 мкг) МР (100 нм). Мыши были инъецированы дважды с 2-недельным интервалом объмом 200 мкл. Они были обескровлены через 2 недели после первой инъекции и 1 неделю после повторной инъекции. Анти- реакция была оценена с помощью набора(суммарное 2 ) на смешанных сыворотках. Титры были выражены как разбавления в средней точке (обратная величина разбавления, дающего 50 наивысшего значения). Результаты показывают, что такое малое количество как 3,1 мкг МР индуцируют сильный рост реакции антител как для первичного,так и для вторичного отклика. Реакция достигает высшей точки при 6,25 мкг и после этого снижается,становясь аналогичной, как для случая без М,когда использовались высокие дозы МР (25 мкг). Характер реакции антител подобна для , 2 и суммарного . Это представляют собой контраст с результатами, полученными для М большего размера ( 500 нм) (см. эксперимент ) и наводит на мысль, что частицымалых размеров (100 нм) являются более эффективными, чем больших размеров (500 нм) (по крайней мере, для гуморального иммунитета), поскольку требуется меньшедля получения максимального эффекта. Наиболее высокая активностьмалого размера была подтверждена в различных экспериментах. Как было показано длябольших размеров(500 нм), влияние адъюванта (добавки в иммунизирующий препарат)выше для 2, чем для суммарногоили . При максимальном результате вторичной реакции (6,25 мкг МР) наблюдается 25-кратный рост 2, в то время как дляили суммарногоон равнялся 7,6 и 4,3, соответственно. В. ИНДУКЦИЯ ИММУНИТЕТА, ОПОСРЕДОВАННОГО КЛЕТКАМИ, С ПОМОЩЬЮ к,АДСОРБИРОВАННОГО НА А 1(ОН)3, ВОЗДЕЙСТВИЕЕсли гуморальный иммунитет является достаточным для защиты против гепатита В, то индукция опосредованного клетками иммунитета (,) может иметь особое значение для лечения этой болезни. Тем не менее требуются новые составы для терапевтических вакцин, поскольку А 1(ОН)3 способен улучшить гуморальный иммунитет, но не опосредованный клетками иммунитет. Мы исследовали влияние МР на индукцию клеток , способных выделять -2 и - (т.е. гамма) интерферона у мышей В/с, иммунизированных с помощью к, адсорбированного на А 1(ОН)3. ЭКСПЕРИМЕНТ . Влияние МР (500 нм) на индукцию клетокпосле иммунизации мышей Ва/с с помощью , адсорбированного на А 1(ОН)3 Группа из 10 мышей / (женского пола, возраста 5 недель) была иммунизирована инъекцией в каждую подушечку на подошве 30 мкл, содержащих 10 мкг , 15 мкг А (как А 1(ОН)3) и 15 мкг МР. Контрольные мыши были инъецированы аналогично таким же количеством к, либо смешанным с(положительный контроль) или адсорбированным на А 1(ОН)3 без МР (отрицательный контроль). Через шесть дней после иммунизации мыши были убиты и были удалены подколенные лимфатические узлы. Клетки лимфатических узлов ( 2,105/мл) культивировались в течение различных периодов времени (от 24 часов до 74 часов) в питательной среде , дополненной 1 отрицательной мышиной сыворотки и содержащей 5 мкг/мл рекНВ. После окончания культивирования было измерено количество -2, - и -4, выделенных в питательной среде. -2 оценивался по его способности стимулировать пролиферацию (быстрое разрастание) (оценивалась путм введения 3 Нтимидина) -2-зависящей линии С (клетки 2) и титр был выражен как показатель (индекс) стимуляции (количество 3 Н-тимидина, введенного в стимулированные клетки/количество 3 Нтимидина, введенного в нестимулированные клетки). Количество -4 и - измерялось, используя имеющиеся в продаже наборы(Голландская биотехнология для - и эндоген для -4). Титры были выражены в пг -/мл. Результаты показывают, что незначительное количество -2, -4 или - выделяетсямышей, иммунизированных , адсорбированным на А 1(ОН)3. Наоборот, высокие уровни -2 (38 при 48 час.) и значительное количество - выделяютсямышей, иммунизированных В,адсорбированным на А 1(ОН)3. Секреция подобна (-) или выше (-2) по сравнению с выделением, наблюдаемым у мышей, иммунизированныхС и секрецияпроисходит раньше.-4 не был обнаружен после иммунизации с помощью , адсорбированного на А 1(ОН)3, даже в присутствии МР. Диаграмма (профиль) секреции показывает, что характерные клетки 1 (-2, - ) были индуцированы иммунизацией адсорбированнымв присутствии МР, но не в отсутствие . Тем не менее, 2 (-4 ) не был обнаружен в этих условиях иммунизации. ЭКСПЕРИМЕНТ . Влияние дозы МР (100 нм) на индукцию клеток 1 после иммунизации мышей/ кН, адсорбированным на А 1(ОН)3 Группы из 5 мышей / были иммунизированы в каждую из 2 подушечек подошвы 30 мкл, содержащими 10 мкг к, адсорбированного на 15 мкг А 1 (как А 1(ОН)3) и с возрастающими количествами(100 нм, 0 до 15 мкг). Через шесть дней после инъекции мыши были убиты и клетки подколенных лимфатических узлов культивировались при 2,106 клеток/мл в среде , дополненной 1 отрицательной мышиной сывороткой в течение различных периодов времени(24 часа до 96/25) в присутствии 5 мкг/мл рек. Выделение -2 измерялось с помощью стимулирования пролиферации клеток 2 и концентрация -2 выражена как показатель стимуляциивыделение - измерялось с помощью коммерческого набора и выражено в пг/мл. Было найдено, что секреция -2 резко возросла при низшей дозе(7,5 мкг) и максимальный результат получен для 15 мкг МР. Секреция -2 обычно более значительна при 24 часах, чем 48 или 72 часах. Секреция - отсутствует, когдаадсорбируется на 1(ОН)3 при отсутствии МР. Малая доза (7,5 мкг) МР индуцирует выделение - и опять же, максимальный результат получается для 15 мкг . В противоположность тому, что наблюдается для 1-2, секреция - задерживается в культуре и возрастает со временем до 96 часов. Взятые вместе эти данные указывают на то, что(100 нм) является мощным побудителем индукции 1, когда он сочетается с , адсорбированным на А 1(ОН). С. ВЫВОД Влияние состава, содержащего , адсорбированного на А 1(ОН)3, и МР на индукцию и гуморального и опосредованного клетками иммунитета у мышей / было исследовано. Результаты показывают, что МР определенно улучшает кинетику и анти-Н реакцию, поскольку намного больше антиНВ антител найдено после и первичной и вторичной иммунизации. Изменилось также качество анти и наблюдалась преимущественно индукция 2, косвенно отражая выделение - и таким образом индукцию опосредованного клетками иммунитета. Прямая оценка индукции клеток 1 составами,содержащими , А 1(ОН)3 и , ясно показывают, чтоявляется мощным побудителем клеток 1, выделяющих и -2 и -. Такого рода состав является, таким образом, важным для развития производства терапевтических вакцин. В качестве таблиц, иллюстрирующих описанные выше эксперименты, см. табл. от 1 до 6 ниже. Пример 6 КЛИНИЧЕС ИСПОЛЬЗОВАНИЕКАК АДЪЮВАНТА К - Предварительные результаты Исследование 002 (продолжение) В этом исследовании сравнивается - с- при испытании на молодых неподготовленных заранее взрослых добровольцах. Конечные вопросы исследования- иммуногенность величина реакции антител анти- кинетика реакции антитела анти-Н- опосредствованный клетками иммунитет, индуцированный обеими вакцинами (и) Здоровые взрослые добровольцы в возрасте между 18 и 30 годами.Они должны быть отрицательными в отношении маркеров НВ и должны быть никгда не вакцинированными против гепатита В. в) план эксперимента- взятие проб кровиИсследование в отношении антител антипроводится перед каждой вакцинацией, после 7 дней, 15 дней, 30 дней каждой вакцинации.Биохимические и гематологические параметры определяются перед и 2 дня после каждой дозы.Кровь для определения опосредованного клетками иммунитета бертся перед и после курса первой вакцинации и бустер-дозы.- Реактогенность Требуется, чтобы субъекты заносили в карточки дневника появление местных или общих признаков и симптомов в день вакцинации и в течение последующих 7 дней. Результаты Результаты до 2 месяцев после второй дозы приведены ниже. Популяция Общее количество 29 субъектов дали свое согласие после их информирования, но только 27 - 15 мужчин и 12 женщин соответствовали входным критериям. 15 субъектов были размещены в группеи 12 в группе . Средний возраст равнялся 22 годам. Безопасность Не было сообщено ни о каких-либо неблагоприятных случаях и никто из субъектов не был удалн или не должен был быть удалн из исследования. Не наблюдались никакие клинические существенные изменения гематологических или биохимических параметров. Охват и острота местных и общих признаков и симптомов похожи в обеих группах вакцин. Иммуногенность Титры антител анти-НВ измерялись до 90 дней,т.е. 2 месяца после второй дозы. Степень превращения сыворотки (, в ) определяется как появление антител в первоначально серонегативных субъектах. Серозащитный показатель определяется как процент субъектов с защитными титрами антител анти. Если, как кажется, нет четкого различия ме 7 9662 жду величиной реакции антителпри сравнении обеих групп, то кинетика реакции различна и имеется ясное преимущество вакцины, содержащей. В самом деле, через 7 дней после второй дозы 93 и 80 субъектов, получивших вакцину М были сероконвертированы и были, соответственно, защищены по сравнению с показателем сероконверсии 95 и показателем серозащиты 58 в группе с -. Это различие поддерживалось до двух месяцев после второй дозы и является особенно ясным в отношении показателя серозащиты. К этому моменту времени все субъекты, которые получили вакцину МР-НВ, защищены по сравнению с 58 субъектов, вакцинированных вакциной с адъювантом квасцами. Исследование МР-НВ-003 (продолжение) Материал и методы подобны тем, которые применялись при исследовании МР-НВ-002(см. выше). Регламенты вакцинации различны Группа Число субъектов Вакцина Регламент Результаты Хотя кинетика реакции антител анти-Н не была так близка, как в предыдущем исследовании, кажется, что в настоящем исследовании могут быть сделаны те же выводы. Субъекты, которые получают вакцину, дополненную , реагируют лучше после второй дозы, чем те, которые были инъецированы вакциной без МР. Все, за исключением одного субъекта (95,8 ), имели защитные титры через один месяц после второй дозы вакцины -, по сравнению с 72,7 в группе с -. К тому же, в сравнении с предыдущим испытанием, похоже на то, что вакцина-, индуцирует более выокие титры антител,чем - (214 и 72 мл ед. изм./мл, соответственно), указывая на то, что, возможно, важным является более длительный интервал между дозами. Выводы В этих двух исследованиях вакцина гепатита В(содержащаякак в Ех- и квасцы) с добавкой (адъювантом) МР, была оценена у здоровых взрослых добровольцев и сравнена с ( -антиген в составе с квасцами) для различных регламентов. Если, как кажется, нет различия в иммуногенности между двумя вакцинами после од ной дозы, то вакцина МР- показывает очевидное преимущество после второй дозы, особенно значительно более высокое процентное содержание субъектов с защитными титрами антител. М также выше в этой группе, когда дозы вводятся с интервалом в два месяца вместо одного месяца. Это могло бы указывать на лучшую затравку(подготовку) реакции, когда МР добавляется к антигену. Поэтому такая вакцина имеет большую ценность в случае субъектов с медленной или низкой реакцией на вакцинирование против гепатита В,таких, как старые люди или иммунокомпромисные субъекты. В качестве таблиц, иллюстрирующих результаты экспериментов, описанных выше, см. табл. от 7 до 9 ниже. Пример 7 ИССЛЕДОВАНИЕ МР - ГПАТИТА А НА МЫШАХ Следующий эксперимент показывает, что добавлениек вакцине против гепатита А оказывает благотворное влияние это отражается в более низком значении Е 50 (доза, выраженная в единицах(метод иммунной пробы, связанный с ферментом) - -, которая дат серологическую реакцию у 50 инъецированных животных). МЕТОДмыши были инъецированы 1 дозой экспериментальной вакцины , содержащей 360-12013,3 /дозу в сочетании с различными концентрациями(0-1,5-6-12,5 мкг/дозу). Через 28 дней после инокуляции были взяты пробы крови и сыворотка была исследованапомощью анализа НААВ(противотела вируса гепатита А), используя 20 сокращение). Был вычислен показатель Е 50 (выраженный в ) и он соответствует дозе, индуцирующей серологическую реакцию в 50 опытных животных. РЕЗУЛЬТАТЫ Результаты подытожены в следующей ниже таблице. Вакцина, не содержащая , имеет показатель 50 123,7 Е, тогда как вакцина, содержащая 1,5 мкг МР/дозу, имеет показатель 50 154. Более высокие дозыоказывают благотворное воздействие (50 наблюдалось при низших значениях Е). При 12,5 мкг/дозу наблюдаемый 50 равнялся 47,1 Е. ВЫВОД Сочетание подходящего количествас вакцинойповышает эффективность действия этой вакцины при испытании на опытах по потенции мыши. 0-6 месяцев Таблица Влияние добавленияк вакцине гепатита А Доза , добавленная к вакцине(мкг/дозу) 0 8 Влияние возрастающих доз(500 ) на иммуногенность РЕК,адсорбированного на А 3 Анти- кция Общеедень 14 69 122 296 371 456 403 Сравнение 3 клинических серий, содержащих или не содержащихреакцияАнтиДозана Доза Сравнение 2 клинических серий, содержащих или не содержащих( 500 М) Реакция АНТИ-НВи 2 Серия Доза НА на Доза МР нти- реакция А 1(ОН)3 (мкг) После иммунизации, как описано в тексте, клетки лимфатических узлов культивировались с 5 мкг рекН /мл в течение указанных периодов времени и измерялась секреция -2, - и -4, исполь зуя, соответственно, контрольную линию Т-клеток 2 и 2 коммерческих набора(метод иммунной пробы, связанной с энзимом). Таблица 6 Влияние различных доз( 100 нм) на индукциюспецифическихклеток Состав Выделение М -- 002 Число Показатель сероконверсии 15 0,0 15 0,0 14 42,9 15 40,0 15 93,3 15 100,0 15 100,0 15 100,0 12 0,0 12 0,0 12 33,3 12 50,0 12 75,0 12 83,3 12 66,7 12 83,3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Вакцинная композиция против гепатита,включающая антиген гепатита, отличающаяся тем,что содержит в качестве адъюванта 3-0-деацилированный монофосфорил-липид А и носитель. 2. Вакцинная композиция по п. 1, отличающаяся тем, что в качестве носителя содержит алюминат. 3. Вакцинная композиция по п. 1, отличающаяся тем, что в качестве носителя содержит эмульсию типа масло в воде. 4. Вакцинная композиция по любому из предшествующих п.п., отличающаяся тем, что антиген гепатита является антигеном против гепатита А. 5. Вакцинная композиция по п. 4, отличающаяся тем, что антиген гепатита А является инактивированным полноклеточным препаратом, происходящим из штамма НМ-175. 6. Вакцинная композиция по любому из п.п. 1-3,отличающаяся тем, что антиген гепатита является антигеном против гепатита В. 7. Вакцинная композиция по п. 6, отличающаяся тем, что антиген включает поверхностный антиген гепатита Вили его вариант. 12 8. Вакцинная композиция по п. 7, отличающаяся тем, чтовключаетантиген(226 аминокислот). 9. Вакцинная композиция по п. 8, отличающаяся тем, чтодополнительно включает предпоследовательность. 10. Вакцинная композиция по п.п. 8 или 9, отличающаяся тем, чтоявляется составной частицей формулы , гдепредставляет модифицированный -белок вируса гепатита В с аминокислотной последовательностью, включающей остатки 12-52, за которыми следуют остатки 133-145 и затем остатки 175-400 -белка ипредставляет белок . 11. Вакцинная композиция по любому из п.п. 610, отличающаяся тем, что дополнительно включает антиген гепатита А. 12. Вакцинная композиция по любому из п.п. 1-3,отличающаяся тем, что антиген гепатита является антигеном против гепатита С или гепатита Д, или гепатита Е. 13. Вакцинная композиция по любому из предшествующих п.п., отличающаяся тем, что содер 9662 жит от 10 до 100 мкг на дозу 3-0-деацилированного монофосфориллипида А. 14. Способ профилактики гепатита, включающий введение вакцинного препарата, отличающийся тем, что вводят эффективное количество вакцины по п. 1.
МПК / Метки
МПК: A61K 39/32, A61K 39/39, A61K 35/78
Метки: против, гепатита, профилактики, вакцинная, способ, композиция
Код ссылки
<a href="https://kz.patents.su/13-9662-vakcinnaya-kompoziciya-protiv-gepatita-sposob-profilaktiki-gepatita.html" rel="bookmark" title="База патентов Казахстана">Вакцинная композиция против гепатита, способ профилактики гепатита</a>
Предыдущий патент: Водная многофазная, устойчивая готовая препаративная форма для защиты растений и способ ее получения
Случайный патент: Состав для производства карамели «Парварда»