Новая кристаллическая модификация торасемида, способ ее получения и фармацевтическая композиция на ее основе
Номер патента: 12088
Опубликовано: 16.01.2006
Авторы: ОРЕШИЧ, Марина, Думич Миленко, ФИСТРИЧ, Инес, ХОРВАТ МИКУЛШИЧ, Ясна, КЛЕПИЧ, Божена, Филич Дарко, ДАНИЛОВСКИ, Александр
Формула / Реферат
Настоящее изобретение относится к новой кристаллической модификации N торасемида, к способу ее получения путем контролируемого подкисления щелочного раствора торасемида неорганической или органической кислотой с добавлением или без добавления кристаллической затравки, к ее использованию в качестве сырья для получения торасемида кристаллической модификации 1 и фармацевтически приемлемых солей торасемида, а также к фармацевтической композиции, содержащей новую кристаллическую модификацию N торасемида.
Текст
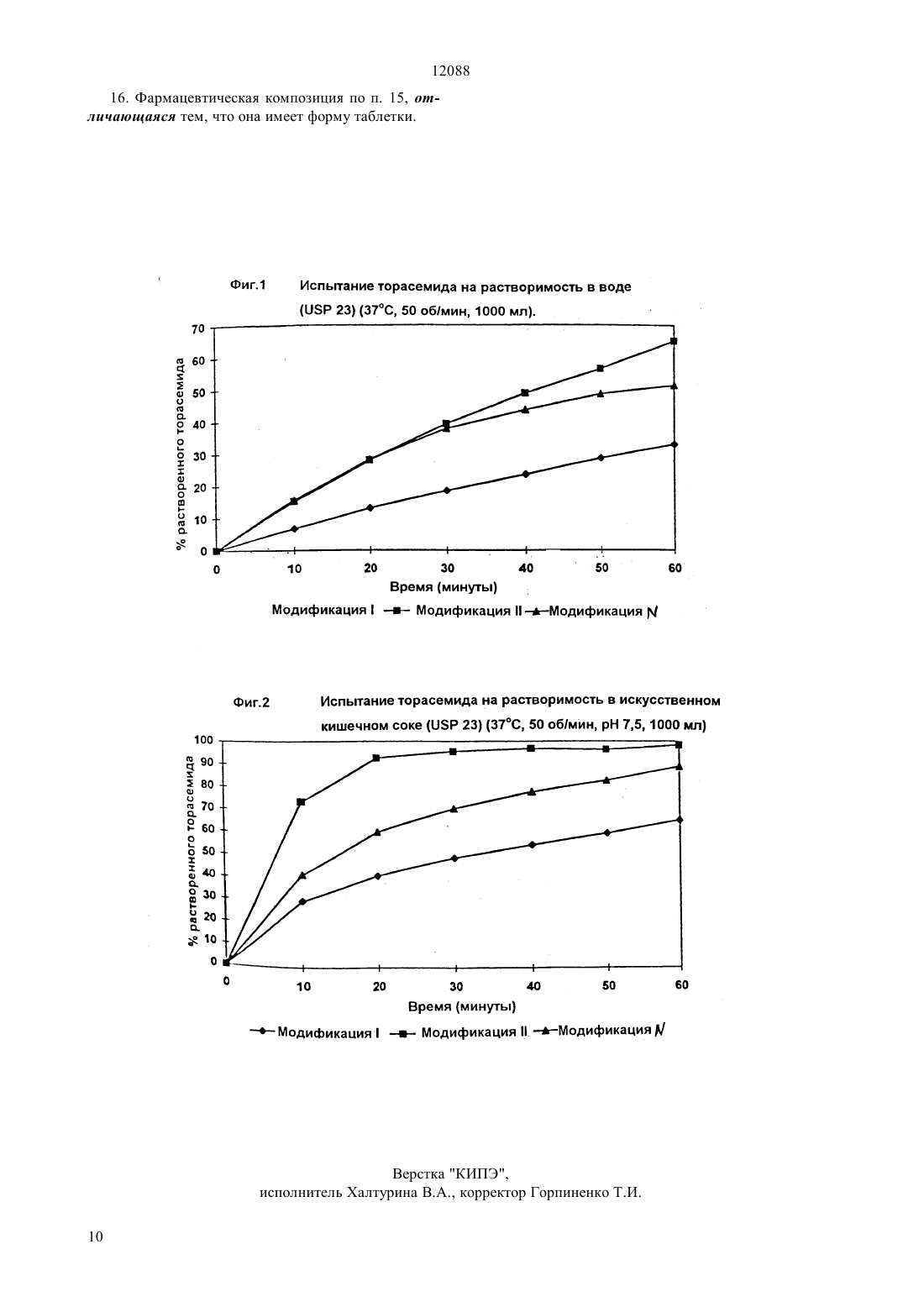
(51)7 07 213/74, 61 31/44 ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(54) НОВАЯ КРИСТАЛЛИЧЕСКАЯ МОДИФИКАЦИЯ ТОРАСЕМИДА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЕ ОСНОВЕ(57) Настоящее изобретение относится к новой кристаллической модификацииторасемида, к способу ее получения путем контролируемого подкисления щелочного раствора торасемида неорганической или органической кислотой с добавлением или без добавления кристаллической затравки, к ее использованию в качестве сырья для получения торасемида кристаллической модификации 1 и фармацевтически приемлемых солей торасемида, а также к фармацевтической композиции, содержащей новую кристаллическую модификациюторасемида. 12088 Настоящее изобретение относится к новой кристаллической модификации-(1 метилэтиламинокарбонил)-4-(3-метил-фениламино)3-пиридинсульфонамида (далее в тексте заявки обозначаемого его общим наименованием торасемид), в частности, к новой кристаллической модификацииторасемида, к способам его получения, к его применимости в качестве исходного материала для получения кристаллической модификацииторасемида и фармацевтически приемлемых солей торасемида, а также к фармацевтической композиции, содержащей указанную новую модификациюторасемида в качестве активного ингредиента. Торасемид является соединением, обладающим интересными фармакологическими свойствами, которые описаны в патенте ФРГ 2516025, 07 213/74,1988 (пример 71). Как диуретик петли Генле,он успешно используется в качестве агента, предотвращающего повреждения сердца или сердечной ткани, вызываемые метаболическими или ионными нарушениями, связанными с ишемией при лечении тромбозов, стенокардии, астмы, гипертензии, отека почек, отека легких, первичного и вторичного альдостеронизма, синдрома Бартера, опухолей, глаукомы для снижения внутриглазного давления при лечении острых или хронических бронхитов, травматического отека мозга, ишемии, сотрясения мозга,метастазов или приступов эпилепсии а также при лечении назальных инфекций, вызванных аллергенами. Способность вещества находиться в более чем одной кристаллической форме определяется как полиморфизм, а сами эти кристаллические формы называют полиморфными модификациями или полиморфами. В основном, полиморфизм обуславливается способностью молекулы вещества изменять свою конформацию или же вступать в различные межмолекулярные или внутримолекулярные взаимодействия, в частности, образовывать водородные связи,что находит свое отражение в различных расположениях атомов в кристаллической решетке в разных полиморфах. Полиморфизм обнаружен в различных органических соединениях. Среди лекарственных препаратов полиморфизм обнаружен в почти 70 барбитуратов, в 60 сульфаниламидов и в 60 стероидов. Около 50 лекарственных средств указанных классов не представлены на рынке в их наиболее стабильной форме (. ,-,,,,, 1996). Различные полиморфы вещества обладают различными энергиями кристаллической решетки и, таким образом, в кристаллическом состоянии они проявляют различные физические свойства, такие как форма кристаллов,плотность, температура плавления, цвет, стабильность, скорость растворения, легкость размалывания, гранулирование, прессование и т. д., которые при использовании полиморфов в лекарственных препаратах могут влиять на приготовление лекарст 2 венных форм, их стабильность, растворимость, биологическую пригодность и, следовательно, на их действие. Полиморфизм лекарственных препаратов является предметом исследований ряда междисциплинарных экспертных групп. (. , . ,. . . 58 (1969) 911 . , .(1997) 405 ,2 (1997) 415 .,. . . 45 (1997) 338 и т.д.), так как обладание знаниями о полиморфизме является непременным условием для критического изучения всего процесса разработки лекарственного препарата. Таким образом, при принятии решения в отношении производства лекарственных препаратов в твердой форме, а также в отношении величины дозы, стабильности, растворимости и ожидаемого действия необходимо установить наличие всех присутствующих в препаратах кристаллических форм (на рынке уже имеется несколько компьютерных программ,например, , входящая в состав программы 2 фирмы., США) и определить стабильность, растворимость и термодинамические свойства каждой из них. Только на основе таких исследований подходящий полиморф может быть выбран для разработки фармацевтических технологий. Из огромного числа таких работ будут упомянуты лишь несколько. Так,и др. (патент США 4.476.248, С 07 С 51/42, 1985) запатентовали новую кристаллическую форму ибупрофена и способ ее получения.и др. (Европейский патент 733635) запатентовали новую кристаллическую форму, способ ее получения и фармацевтическую технологию приготовления препарата оланзапин,содержащего эту новую кристаллическую форму и др. (Европейский патент 749969) запатентовали новый способ получения полиморфной формыставудина из смеси, содержащей одну или более форм ,и. и др. (Европейский патент 708103) запатентовали новую кристаллическую форму ирбесартана, способ ее получения и фармацевтическую технологию приготовления препарата, содержащего эту кристаллическую форму. Известно ( . В 34 (1978), 2659-2662 и. В 34 (1978), 1304-1310), что торасемид может находиться в двух кристаллических модификациях, отличающихся по параметрам ячейки кристаллической решетки, что подтверждено измерением дифракции рентгеновских лучей на их монокристаллах. Обе модификации образуются одновременно при медленном испарении растворителя из раствора торасемида в смеси петролейного эфира/этанола. Модификация , имеющая температуру плавления 169 С, кристаллизуется с образованием моноклинной решетки с пространственной группой симметрии Р 21/ (призмы), тогда как модификация, имеющая температуру плавления 162 С, кристаллизуется с образованием моноклинной решетки 12088 пространственной группы симметрии Р 2/ (слои). Кроме того, в работе 25 (1994),734-750, была установлена точка плавления для модификации , равная 169,22 С. Согласно примеру 71 патента ФРГ 25 16 025,07 213/74. 1988, торасемид получен в кристаллической форме с точкой плавления 163-164 С. В патенте США 4.743.693, 07 217/70, 1989 и переиздании патента США 34.580 или в патенте США 4.822.807, 07 213/74, 1990 и переиздании патента США 34.672 раскрыт способ получения стабильной модификацииторасемида из торасемида нестабильной модификациипутем добавления в каталитических количествах (1 ) стабильной модификацииторасемида в водную суспензию нестабильной модификации и перемешивания смеси при температуре от комнатной до 90 С в течение времени в пределах от 3 часов до 14 дней. В патенте США 4.743.693, 07 217/70, 1989 и переиздании патента США 34.580 заявлено, что стабильная модификацияторасемида (моноклинная, пространственная группа симметрии Р 21/) имеет точку плавления 162 С, а нестабильная модификацияторасемида (моноклинная, пространственная группа симметрии Р 2/) имеет точку плавления 169 С, что противоречит данным, приведенным в. 34 (1978), 2659-2662,. 34 (1978), 13041310 и 25 (1994), 734-750. В реферате патента США 4.822.807 07213/74, 1990, авторы приписывают точку плавления 162 С стабильному полиморфуторасемида, а точку плавления 169 С - нестабильному полиморфуторасемида, тогда как в формуле изобретения указанного патента заявлены другие точки плавления для того и другого полиморфа, а именно, для полиморфаточка плавления 169 С, а для полиморфа- точка плавления 162 С. В реферате переиздания патента США 34.672 авторы приписывают точку плавления 162 С чистой модификацииторасемида, а точку плавления 169 С - модификацииторасемида, тогда как в формуле изобретения заявлена точка плавления 159161,5 С для чистого полиморфа и точка плавления от примерно 157,5 до примерно 160 С для нестабильного полиморфа . К настоящему времени неожиданно найдено, что путем контролируемого подкисления щелочных растворов торасемида неорганическими или органическими кислотами с добавлением или без добавления кристаллической затравки при температуре между 0 и 35 С в течение времени в пределах от 15 минут до 25 часов может быть получена новая кристаллическая модификацияторасемида. Под щелочными растворами торасемида, в соответствии со способом настоящего изобретения, подразумеваются щелочной экстракт исходной реакционной смеси для синтеза торасемида, щелочные растворы любой кристаллической модификации ,илиторасемида или щелочные растворы любых взаимных смесей кристаллических модификаций , илиторасемида. В способе настоящего изобретения для получения щелочных растворов модификаций торасемида могут использоваться водные растворы гидроокисей лития, натрия и калия, а также водные растворы карбонатов натрия или калия. В соответствии с настоящим изобретением, подкисление щелочных растворов торасемида может быть произведено с помощью неорганических кислот, таких как соляная, серная, фосфорная и азотная, а также с помощью органических кислот, таких как муравьиная, уксусная, пропионовая, щавелевая,винная,метансульфокислота,и ртолуолсульфокислота. В качестве кристаллической затравки в способе настоящего изобретения может использоваться кристаллический порошок одного из изоструктурных веществ, в частности, кристаллический порошок кристаллической модификацииторасемида. Кроме того, было обнаружено, что при использовании способа настоящего изобретения не происходит разложения торасемида, и примеси, которые могут присутствовать в щелочных экстрактах исходной реакционной смеси для синтеза торасемида или в модификациях ,илиторасемида, превращаются, в соответствии с настоящим способом, в базовые модификации, т.е. получается химически чистая кристаллическая модификацияторасемида. Более того, было обнаружено, что новая кристаллическая модификацияторасемида является стабильной как при нормальных условиях хранения,так и в условиях повышенной влажности. Это означает, что не происходит ее трансформации ни в нестабильную модификациюторасемида, ни в стабильную модификацию 1 торасемида. Новая кристаллическая модификацияторасемида имеет характерную порошковую рентгенограмму, полученную путем дифракции рентгеновских лучей на порошковых образцах торасемида новой кристаллической модификациина дифрактометре 3710 фирмыпод действием Си рентгеновских лучей (1)1,54046(СК 2)1,54439 А. Полученные таким образом характеристические интервалы между плоскостями кристаллической решетки, обозначенные каки выраженные в ангстремах, и соответствующие им характеристические отношения интенсивностей,обозначенные как /0 и выраженные в , представлены в табл. 1. Кроме того, путем измерения монокристалла новой кристаллической модификацииторасемида на четырехкружном дифрактометре 1100/ фирмыпод действием Мо-рентгеновских лучей (МоК)0,71073 А были получены основные кристаллографические данные для кристаллической ячейки, которые при сравнении с литературными данными для кристаллической модификациииторасемида ( . 34 (1978), 2659-2662 и. 34 (1978), 1304-1310) указывают на то,что это есть совершенно новая кристаллическая модификацияторасемида. Основные кристаллографические данные (дифракция на монокристалле) для модификаций ,и для новой кристаллической модификацииторасемида представлены в табл. 2. Таблица 2 Кристаллическая модификация торасемида Параметры Кристаллическая система Группа симметрии а(А) Новая кристаллическая модификацияторасемида, полученная в соответствии со способом настоящего изобретения, может быть переведена с помощью обычных способов в кристаллическую модификациюторасемида, т. е. эта новая модификация может служить в качестве исходного сырья для получения известной кристаллической модификации 1 торасемида. Новая кристаллическая модификацияторасемида, полученная в соответствии с настоящим изобретением, может быть преобразована с помощью известных способов в соли торасемида, приемлемые для изготовления лекарств. Профиль растворения (полученный в соответствии со стандартом фармакопеи США -23) новой кристаллической модификацииторасемида в воде и в искусственном кишечном соке и профили растворения известных кристаллических модификаций 1 иторасемида в тех же самых жидкостях существенно различаются.(скорость растворения внутри организма) новой кристаллической модификацииторасемида в модели искусственного желудочного сока превышает 1 мг см-2 мин-1, что указывает на потенциально хорошую биологическую доступность. Новая кристаллическая модификацияторасемида, полученная согласно способу настоящего изобретения, представляет собой текучий порошок с призматической формой кристаллов, обладающих текучестью, который легко приходит в состояние свободного течения, в котором отсутствует накопление статического заряда. Новая кристаллическая модификацияторасемида, полученная в соответствии со способом настоящего изобретения, может успешно использоваться как в качестве диуретика, так и агента, предотвращающего повреждения сердца или сердечной ткани, вызываемые метаболитическими или ионными нарушениями, сопутствующими ишемии а также как средство, применяемое при лечении тромбозов,стенокардии, астмы, гипертонии, отека почек, отека легких, первичного и вторичного альдостеронизма,синдрома Бартера, опухолей, глаукомы для сниже ния внутриглазного давления при лечении острых или хронических бронхитов, травматического отека мозга, ишемии, сотрясения мозга, метастазов или эпилептических припадков а также в лечении назальных инфекций, вызываемых аллергенами. Настоящее изобретение относится также к фармацевтическим формам, таким как таблетки, содержащим в качестве активного ингредиента новую кристаллическую модификациюторасемида в сочетании с одной или большим числом приемлемых добавок, таких как сахар, крахмал, производные крахмала, целлюлоза, производные целлюлозы,агенты, облегчающие процесс прессования, вещества для устранения слипания и, возможно, агенты,регулирующие текучесть порошка. При использовании новой кристаллической модификацииторасемида для приготовления фармацевтических форм могут также применяться стадии процесса, проходящие в водной среде, например, грануляция. Исходные материалы для способа настоящего изобретения, т.е. щелочные экстракты исходных реакционных смесей для синтеза торасемида, могут быть получены согласно патенту ФРГ 25 16 025,тогда как модификациииторасемида могут быть получены в соответствии с. 34 (1978),1304-1310. Настоящее изобретение иллюстрируется следующими примерами. Пример 1 Технически чистая новая кристаллическая модификацияторасемида Исходный щелочной экстракт реакционной смеси для синтеза торасемида (1000 мл), приготовленный согласно патенту ФРГ 25 16 025, 07 213/74, 1988,был подкислен 10 водным раствором уксусной кислоты при добавлении 1,4 г кристаллической модификацииторасемида. Суспензия перемешивалась при комнатной температуре в течение 90 минут. Жидкость отсасывалась, а полученные кристаллы были промыты 1 л дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 125 г кристаллической мо 5 12088 дификацииторасемида, температура плавления 162-165 С. Порошковая рентгенограмма полученного таким способом образца соответствовала новой кристаллической модификацииторасемида. Содержание торасемида, согласно данным жидкостной хроматографии высокого разрешения , составляло более 99 . Пример 2 Кристаллическая модификацияторасемида(1000 г), полученная согласно примеру 1, была растворена в 10-кратном количестве 5 водного раствора гидроокиси калия, и при температуре 20 С полученный раствор был подкислен 5 водным раствором соляной кислоты при добавлении 10 г кристаллической модификацииторасемида. Суспензия перемешивалась при 20 С в течение 120 минут. Жидкость была отсосана, а кристаллы промыты 4 л дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 961 г модификацииторасемида,температура плавления - 165 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , составляло более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 3 1,00 г кристаллической модификацииторасемида, полученной согласно. 34 (1978),1304-1301, был растворен в 10-кратном количестве 10 водного раствора карбоната натрия, и при температуре 15 С полученный раствор был подкислен 5 водным раствором серной кислоты при добавлении 0,1 г модификацииторасемида. Суспензия перемешивалсь при 15 С в течение 120 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,95 г кристаллической модификацииторасемида, температура плавления - 165-166 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т. е. соответствовало химически чистому торасемиду. Пример 4 1,00 г кристаллической модификацииторасемида, полученной согласно. 34 (1978),1304-1310, был растворен в 10-кратном количестве 10 водного раствора карбоната калия, затем при температуре 15 С полученный раствор был подкислен 5 раствором азотной кислоты при добавлении 0,10 г модификацииторасемида. Суспензия перемешивалась при 15 С в течение 120 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,96 г кристаллической модификацииторасемида,температура плавления - 164-166 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,54 , т.е. соответствовало химически чистому торасемиду. Пример 5 Смесь кристаллических модификаций 1 иторасемида (1,00 г), приготовленная согласно. 34 (1978), 1304-1310, была растворена в 10 кратном количестве 10 водного раствора гидроокиси лития, и затем при комнатной температуре полученный раствор был подкислен 5 водным раствором фосфорной кислоты при добавлении 0,10 г модификацииторасемида. Суспензия перемешивалась при 15 С в течение 240 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,97 г кристаллической модификацииторасемида,температура плавления - 165-166 С. Порошковая рентенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 6 Смесь кристаллических модификацийиторасемида (1,00 г), приготовленных согласно. 34 (1978), 1304-1310, и примеру 1, была растворена в 10-кратном количестве 5 водного раствора гидроокиси калия, и затем при температуре 30 С полученный раствор был подкислен 10 водным раствором винной кислоты при добавлении 0,10 г модификацииторасемида. Суспензия перемешивалась при 30 С в течение 180 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,93 г кристаллической модификацииторасемида, температура плавления - 164-166 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 7 Смесь кристаллических модификацийиторасемида (1,00 г), приготовленных согласно. 34 (1978), 1304-1310, и примеру 1, была растворена в 10-кратном количестве 5 водного раствора гидроокиси натрия, и затем при температуре 35 С полученный раствор был подкислен 5 водным раствором пропионовой кислоты при добавлении 0,10 г модификацииторасемида. Суспензия перемешивалась при 35 С в течение 90 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было по 12088 лучено 0,87 г кристаллической модификацииторасемида, температура плавления - 165 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 8 Смесь кристаллических модификаций ,иторасемида (1,00 г), приготовленных согласно. 34 (1978), 1304-1310, и примеру 1, была растворена в 10-кратном количестве 10 водного растора карбоната натрия, и затем при температуре 25 С полученный раствор был подкислен 5 водным раствором р-толуолсульфокислоты при добавлении 0,10 г модификацииторасемида. Суспензия перемешивалась при 25 С в течение 60 минут. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,93 г кристаллической модификацииторасемида, температура плавления - 164-166 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 9 1,00 г кристаллической модификацииторасемида, полученной согласно. 34 (1978),1304-1310, был растворен в 10-кратном количестве 10 водного раствора карбоната калия, и затем при температуре 15 С полученный раствор постепенно подкислялся 10 водным раствором уксусной кислоты при одновременном постепенном снижении температуры смеси до 0 С. При этой температуре суспензия перемешивалась в течение 25 часов. Жидкость была отсосана, а кристаллы промыты 4 мл дистиллированной воды и высушены в вакуумной сушилке при 50 С в течение 3 часов. Было получено 0,94 г кристаллической модификацииторасемида,температура плавления - 164-166 С. Порошковая рентгенограмма полученного таким образом образца соответствовала кристаллической модификацииторасемида. Содержание торасемида, согласно данным , было более 99,5 , т.е. соответствовало химически чистому торасемиду. Пример 10 Изготовление 2,5 мг таблеток. Торасемид кристаллической модификациисмешивался с лактозой и кукурузным крахмалом обычным способом, гранулировался с водой, высушивался и просеивался через сито (гранулят 1). Двуокись кремния в коллоидном виде смешивалась со стеаратом магния, просеивалась через сито и примешивалась в гранулят 1. Эта смесь затем таблетировалась обычным способом. Для изготовления 100.000 таблеток требуется торасемид - кристаллическая модификация 0,25 кг лактоза () 6,05 кг кукурузный крахмал 1,60 кг коллоидная двуокись кремния( 200) 60,00 г стеарат магния 40,00 г вода бидистиллированная 1,20 кг Пример 11 Изготовление 100 мг таблеток Торасемид кристаллической модификациисмешивался с лактозой, кукурузным крахмалом и частью стеарата магния обычным способом. Смесь прессовалась и просеивалась через сито, чтобы получить зерна желаемого размера и желаемого распределения зерен по размерам (гранулят 1). Коллоидная двуокись кремния смешивалась со стеаратом магния, просеивалась и примешивалась в гранулят 1. Затем эта смесь таблетировалась обычным способом. Для изготовления 100.000 таблеток требуется торасемид - кристаллическая модификация 10,00 кг лактоза 2,0 кг кукурузный крахмал 7,7 кг коллоидная двуокись кремния( 200) 0,2 кг стеарат магния 0,1 кг Пример 12 Микрокристаллические модификации , ,торасемида, полученные согласно работе. 34 (1978), 1304-1310, и примеру 1, были подвергнуты испытаниям на растворимость в воде и в искусственном кишечном соке при 37 С ( 23). Результаты этих испытаний приведены в табл. 3 и 4. Таблица 3 Испытание торасемида на растворимость в воде ( 23) Таблица 4 Испытание торасемида на растворимость в кишечном соке ( 23) растворенного торасемида мод.мод.0 0 0 10 29,4 73,3 20 40,5 92,6 30 48,4 95,5 40 54,2 96,8 50 59,2 96,3 60 65,0 98,2 Результаты, приведенные в табл. 3, представлены на фиг. 1. Результаты, приведенные в табл. ны на фиг. 2. ФОРМУЛА ИЗОБРЕТЕНИЯ 4,1829 4,0768 1. Новая кристаллическая модификациятора 3,9377 семида, характеризующаяся тем, что ее порошковая 3,8659 рентгенограмма, полученная на дифрактометре 3,84293710 под действием С-рентгеновских 3,7801 лучей (1)1,54046 А и (СК 2)1,54439 3,7248 А, представлена следующими расстояниями между 3,6239 плоскостями кристаллической решетки 3,5556 3,4825 Новая кристаллическая моди 3,4130 1,5057 1,4521 1,3773 2. Новая кристаллическая модификацияторасемида по п. 1, характеризующаяся тем, что согласно данным по дифракции рентгеновских лучей на образце монокристалла, полученным на четырехкружном дифрактометре 1100/ под действием Мо-рентгеновских лучей(МоК)0,71073 А, она имеет следующие основные кристаллографические характеристики Параметры Новая кристаллическая модификация -торасемида Кристаллическая система моноклинная Группа симметрии 21/ а(А) 11,430 4 х 2 3. Новая кристаллическая модификациятора- ная,метан-сульфокислота или рсемида по пп. 1-2, характеризующаяся тем, что она толуолсульфокислота. является химически чистой. 11. Способ по пп. 6-10, характеризующийся тем,4. Новая кристаллическая модификациятора- что в качестве кристаллической затравки использусемида по пп. 1-3, характеризующаяся тем, что она ют кристаллический порошок одного из изокристалне содержит воды. лических веществ, предпочтительнее всего - кри 5. Новая кристаллическая модификациятора- сталлический порошок кристаллической модификасемида по пп. 1-4, характеризующаяся тем, что она цииторасемида. не содержит растворителя. 12. Новая кристаллическая модификациятора 6. Способ получения новой кристаллической мо- семида по пп. 1-11, характеризующаяся тем, что она дификацииторасемида по пп. 1-5, характеризую- приемлема в качестве сырья для получения кристалщийся тем, что щелочной раствор торасемида под- лической модификацииторасемида. вергают контролируемому подкислению неоргани 13. Новая кристаллическая модификациятораческими или органическими кислотами с добавлени- семида по пп. 1-11, характеризующаяся тем, что она ем или без добавления кристаллических затравок приемлема в качестве сырья для получения фармапри температуре между 0 С и 35 С в течение вре- цевтически приемлемых солей торасемида. мени в пределах от 15 минут до 25 часов. 14. Новая кристаллическая модификациятора 7. Способ по п. 6, характеризующийся тем, что в семида по пп. 1-11, характеризующаяся тем, что она качестве щелочного раствора торасемида использу- приемлема в качестве диуретика в качестве агента,ют исходный щелочной экстракт реакционной смеси предотвращающего повреждения сердца или сердля синтеза торасемида. дечной ткани, вызываемые метаболическими или 8. Способ по п. 6. характеризующийся тем, что в ионными нарушениями, сопутствующими ишемии в качестве щелочного раствора торасемида использу- качестве средства, применяемого при лечении тромют щелочные растворы любой кристаллической мо- бозов, стенокардии, астмы, гипертонии, отека почек,дификации ,илиторасемида или растворы лю- отека легких, первичного и вторичного альдостеробых взаимных смесей кристаллических модифика- низма, синдрома Бартера, опухолей, глаукомы для ций ,илиторасемида. снижения внутриглазного давления при лечении 9. Способ по пп. 6-8. характеризующийся тем. острых и хронических бронхитов, травматических что для получения щелочных растворов торасемида отеков мозга, ишемии, сотрясения мозга, метастазов используют водные растворы гидроокисей лития, или эпилептических припадков, а также при лечении натрия, калия и водные растворы карбонатов натрия назальных инфекций, вызванных аллергенами. и калия. 15. Фармацевтическая композиция, состоящая из 10. Способ по пп. 6-9, характеризующийся тем, активного ингредиента в сочетании с одним или бочто для подкисления используют неорганические лее из фармацевтически приемлемых наполнителей,кислоты, такие как соляная, серная, фосфорная или добавок или разбавителей, отличающаяся тем, что азотная, или органические кислоты, такие как му- в качестве активного ингредиента она содержит норавьиная, уксусная, пропионовая, щавелевая, вин- вую кристаллическую модификациюторасемида по пп. 1-11. 9 12088 16. Фармацевтическая композиция по п. 15, отличающаяся тем, что она имеет форму таблетки.
МПК / Метки
МПК: A61P 7/10, A61P 9/10, C07D 213/74, A61K 31/44
Метки: способ, торасемида, кристаллическая, получения, композиция, основе, фармацевтическая, модификация, новая
Код ссылки
<a href="https://kz.patents.su/10-12088-novaya-kristallicheskaya-modifikaciya-torasemida-sposob-ee-polucheniya-i-farmacevticheskaya-kompoziciya-na-ee-osnove.html" rel="bookmark" title="База патентов Казахстана">Новая кристаллическая модификация торасемида, способ ее получения и фармацевтическая композиция на ее основе</a>
Предыдущий патент: Емкость для транспортирования и хранения нефти и нефтепродуктов
Следующий патент: Способ получения ксенонового концентрата
Случайный патент: Способ извлечения осмия и рения из промывной серной кислоты