Полипептид, лекарственное средство, способ получения полипептида (варианты), фрагмент ДНК (варианты), экспрессирующий вектор (варианты), штамм E.coli (варианты), фармацевтическая композиция (варианты)
Формула / Реферат
Описан новый белок, полученный из мочи путемэкстракции и очистки с помощью ионообменнойхроматографии и высокоразрешающейхроматографии.
Текст
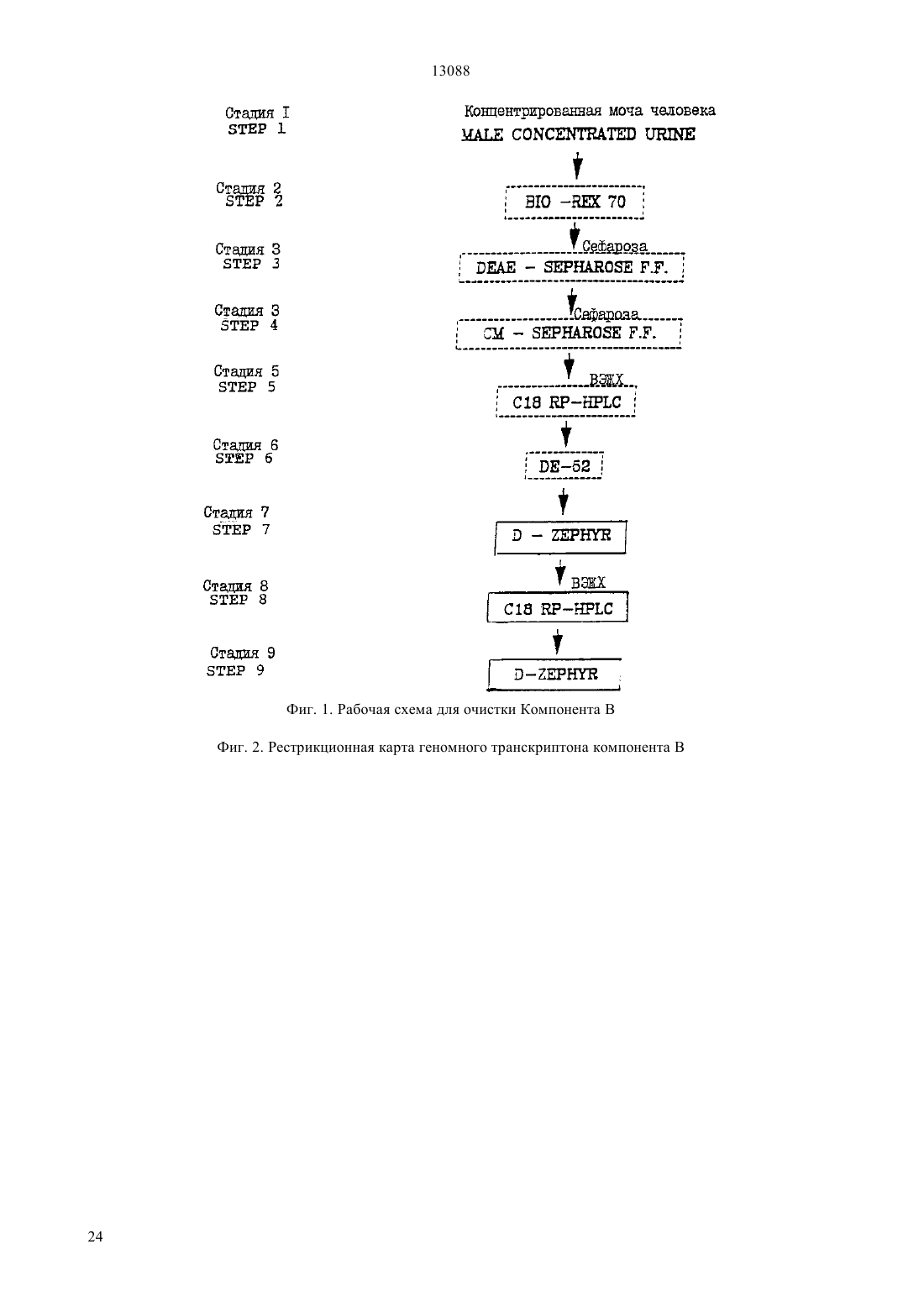
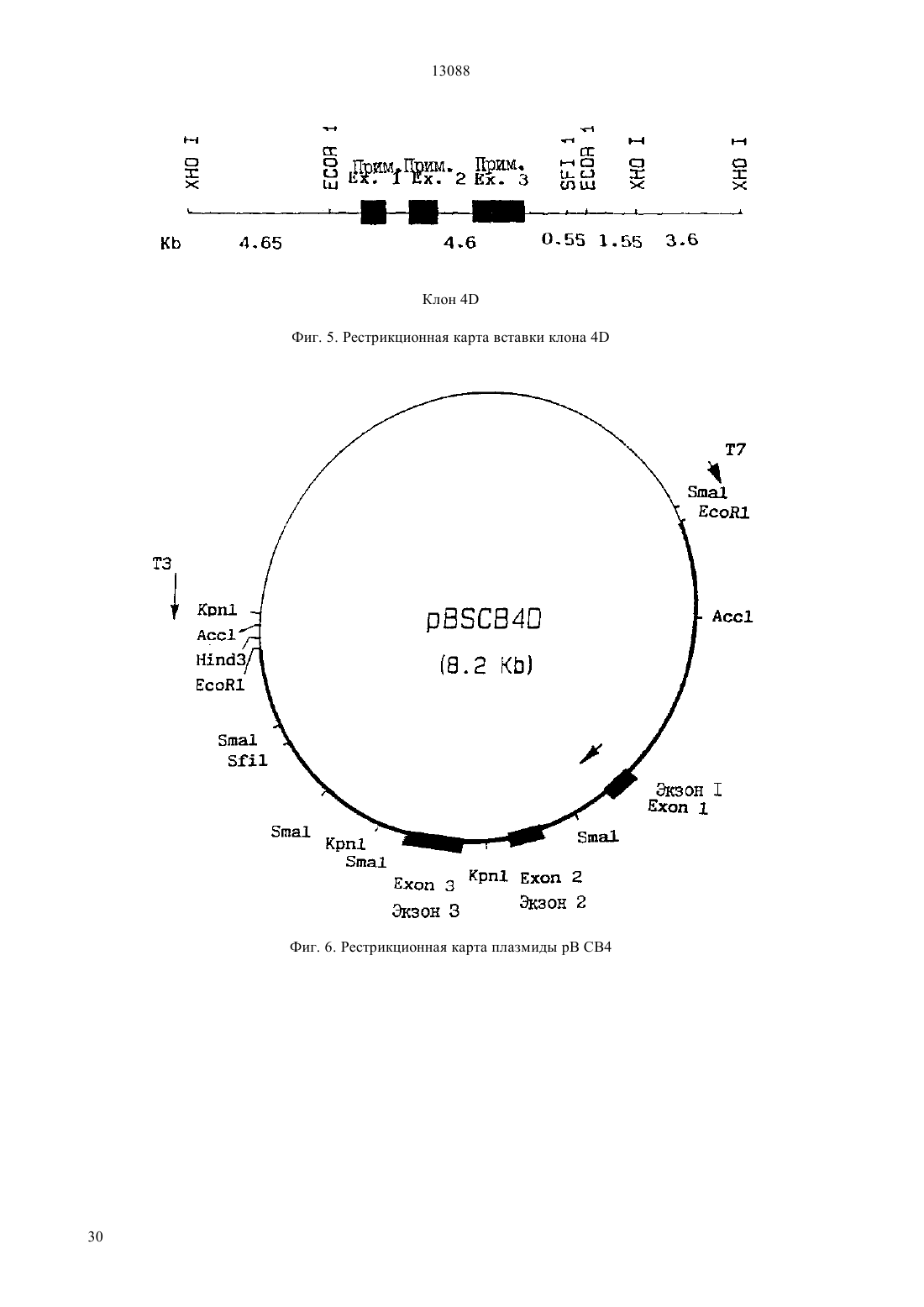
(51)7 07 14/47, 12 15/12, 12 1/21, 61 35/22 ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(73) Апплайд Резч Системз АРС Холдинг Н.В.(54) СРЕДСТВО, СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА (ВАРИАНТЫ), ФРАГМЕНТ ДНК(57) Описан новый белок, полученный из мочи путем экстракции и очистки с помощью ионообменной хроматографии и высокоразрешающей хроматографии. 13088 Настоящее изобретение относится к новому белку, названному Компонентом В. Более конкретно,настоящее изобретение относится к новому белку,получаемому из мочи к получению этого белка из мочи к его синтезу посредством техники рекомбинантных ДНК с использованием геномной ДНК или кДНК, кодирующей указанный новый белок а также к фармацевтической композиции, содержащей этот белок и ее использованию в терапевтических целях. Новый белок имеет относительную низкую молекулярную массу и полипептидную природу и может быть выделен в процессе экстракции и очистки производных мочи. Для этого мочу человека обрабатывают адсорбирующими материалами, такими, как каолин, затем подвергают фильтрации, ионообменной хроматографии и высокоразрешающей хроматографии, предпочтительно в соответствии с нижеописанной техникой и после лиофилизации получают соединение в виде белого аморфного порошка, который в обращенно-фазовой жидкостной хроматографии высокого давления (ОФ-ЖХВД) перемещается как один пик и который имеет молекулярную массу около 9 кДа, как было показано с помощью электрофореза в полиакриламидном геле с дедецилсульфатом натрия (ДСН-ПААГ), проводимого в восстанавливающих условиях. Этот белок был назван Компонентом В. Аминокислотная последовательность Компонента В представлена ниже как Е 1. Настоящее изобретение относится к получению нового белка, названного Компонентом В, способом,предусматривающим выделение сырой фракции самого соединения из диализованного концентрата мочи после ее обработки адсорбирующим агентом и очистки с помощью ионообменной хроматографии и высокоразрешающей хроматографии, как описано ниже. Предпочтительно, если белок настоящего изобретения экстрагируют из мочи человека, поскольку она существует в больших количествах, а поэтому может быть использована в промышленном производстве. Более конкретно, настоящее изобретение относится к полипептиду, имеющему последовательность 1, к его солям, функциональным производным,предшественникам, активным фракциям, а также к их активным мутантам, т. е. к другим белкам или полипептидам, в которых одна или несколько аминокислот были удалены, замещены другими аминокислотами или добавлены в целях получения полипептидов или белков, имеющих активность, аналогичную активности Компонента В кроме того, настоящее изобретение также относится к гибридным белкам, т. е. полипептидам, содержащим Компонент В или его мутацию, лигированный с другим белком,и имеющим более продолжительное время полужизни в физиологических жидкостях в организме. Поэтому Компонент В может быть подвергнут слиянию с другим белком, например, таким, как иммуноглобулин. Термин соли, используемый в настоящем описании, означает соли карбоксильных групп и соли функциональных аминогрупп соединений, синтезируемые известными способами. Соли карбоксильных групп могут быть неорганическими солями, например, такими, как соли натрия, калия и кальция, а также солями, образованными органическими основаниями, такими, как амины, например, триэтиламин, аргинин или лизин. Соли аминогрупп могут представлять собой соли,образованные неорганическими кислотами, такими,как соляная кислота, и органическими кислотами,такими, как уксусная кислота. Термин функциональные производные, используемый в настоящем описании, относится к производным, которые могут быть получены из функциональных групп, присутствующих на боковых цепях аминокислотных остатков или на концевых - или С-группах, в соответствии с известными методами и которые входят в объем настоящего изобретения в том случае, если они являются фармацевтически приемлемыми, т. е. обладают активностью, аналогичной активности белка,или не наделяют фармацевтические композиции,содержащие указанные производные, токсическими свойствами. Примерами таких производных являются, например, сложные эфиры или алифатические амиды карбоксильных групп и -ацильные производные свободных аминогрупп, О-ацильные производные свободных гидроксильных групп, а также производные, образованные ацильными группами, например,алканоильными или ароильными группами. Термин предшественники означает соединения,которые в организме человека или животного превращаются в Компонент В. Термин активные фракции белка настоящего изобретения означает любой фрагмент или предшественник полипептидной цепи самого соединения, взятый отдельно или в комбинации со связанными с ним родственными молекулами или остатками, например, остатками сахаров или фосфатов, или агрегаты полипептидной молекулы, при условии, что такие фрагменты или предшественники как лекарственные средства обладают активностью аналогичной активности Компонента В. Настоящее изобретение также относится к смеси полипептидов и производных, определенных выше. Во втором варианте своего осуществления, настоящее изобретение относится к способу получения Компонента В, предусматривающему выделение сырой фракции из диализованного концентрата мочи, после его обработки адсорбирующим агентом и очистки с помощью ионообменной хроматографии и высокоразрешающей хроматографии. Компонент В предпочтительно получают способом, проиллюстрированным на фиг. 1 и включающем в себя следующие стадии а) адсорбция мочи при кислотном рН на каолине и ее экстракция аммиаком) элюировавие фракции (а) на смоле 70 с использованием аммиака с) элюирование фракциина ЕАЕСефарозной смоле с использованием ацетатного буфера) элюирование фракции (с) на -Сефарозной смоле с использованием ацетатного буфера е) элюирование фракциина С 18-смоле(ВЭЖХ) с использованием смеси ацетатного буфера и ацетонитрила(ВЭЖХ) с использованием смеси водной трифторуксусной кислоты и ацетонитрила) элюирование фракциина смоле с использованием ацетатного буфера. Кроме того, настоящее изобретение относится к рекомбинантным ДНК-молекулам, которые содержат нуклеотидную последовательность, кодирующую полипептид настоящего изобретения, его активные мутанты или гибридные белки а также к содержащим их векторам экспрессии к клеткамхозяевам, трансформированным этими векторами, и к способу получения указанных полипептидов, их активных мутантов или гибридных белков путем культивирования указанных трансформированных клеток в соответствующей культуральной среде. Термин рекомбинантные ДНК-молекулы относится к геномной ДНК, кДНК, синтетической ДНК и к комбинациям. В частности, настоящее изобретение относистся к нуклеотидным последовательностям,проиллюстрированным в 2 и Е 3, соответственно.2 представляет собой геномную ДНКпоследовательность, кодирующую Компонент В. На фиг. 2 показана рестрикционная карта транскрипционной единицы Компонента В.3 представляет собой кДНКпоследовательность, кодирующую Компонент В. На фиг. 8 показана полная кДНК-последовательность, кодирующая Компонент В, в которой указаны сайты рестрикции. Клонирование Компонента В может быть осуществлено различными способами. В одном из таких способов получают олигонуклеотид или смесь нуклеотидов, последовательность которых, выведенную исходя из последовательности Компонента В или его фрагмента, используют в качестве зонда для клонирования кДНК или геномной ДНК, кодирующей Компонент В.4 представляет собой аминокислотные последовательности, кодируемые геномной ДНК(2) и кДНК (3). Настоящее изобретение также относится к рекомбинантным ДНК-молекулам, которые гибридизируются с ДНК-последовательностью, кодирующей Компонент В или его фрагмент. Нужный ген может содержать или не содержать природные интроны и может быть получен, например, путем экстракции из соответствующих клеток с последующей очисткой известными методами. Соответствующие препараты ДНК, как человеческая геномная ДНК, разрезают подходящими способами,предпочтительно с использованием рестриктирующих ферментов, и полученные таким образом фрагменты вводят в соответствующие рекомбинантные векторы для создания библиотеки ДНК. Указанные векторы могут быть отобраны с помощью синтетических олигонуклеотидных зондов в целях идентификации последовательности, кодирующей Компонент В настоящего изобретения. В соответствии с настоящим изобретением, геномную ДНК Компонента В выделяют и клонируют. С другой стороны, из клеток, экспрессирующих Компонент В, может быть выделена соответствующая мРНК и использована для продуцирования комплементарной ДНК (кДНК) известными методами. Эта кДНК, после превращения в двойную спираль,может быть введена в соответствующий вектор, который затем используют для трансформации подходящей клетки-хозяина. После этого, культуры отбирают с использованием соответствующего зонда в целях получения кДНК, кодирующей целевые последовательности. После выделения нужного клона кДНК подвергают, в основном, таким же манипуляциям, что и геномную ДНК. кДНК не содержат интроны. Из-за вырожденности генетического кода могут быть использованы различные кодоны, кодирующие конкретную аминокислоту так, чтобы продуцировался один или несколько олигонуклеотидов, каждый из которых способен кодировать фрагменты Компонента В. Однако лишь один член этого пула имеет нуклеотидную последовательность, идентичную последовательности данного гена. Присутствие этого члена в пуле и его способность гибридизироватъся с ДНК также в присутствии других членов пула позволяет использовать группу нефракционированных олигонуклеотидов таким ж образом, как один олигонуклеотид, который должен быть использован для клонирования гена, кодирующего целевой пептид. Альтернативно,единственный нуклеотид, содержащий последовательность, относительно которой можно теоретически с наиболее высокой степенью вероятности предположить, что она способна кодировать генные фрагменты Компонента В (согласно описанию, приведенному в(правила использования кодонов) -.., .., 1831-12 (1985, позволяет идентифицировать комплементарную ДНК, кодирующую Компонент В или в его фрагмент. Способы гибридизации нуклеиновых кислот известны и описаны в литературе (см., например, Т..,,(1985. Гибридизация с использованием указанного зонда или группы нуклеотидных зондов позволяет идентифицировать в геномной или кДНК-библиотеке ДНК-последовательности, способные к такой гибридизации, которые после последующего анализа подтверждали свою способность кодировать полипептид настоящего изобретения(т. е. Компонент В). Олигонуклеотид, содержащий такую комплементарную последовательность, может быть синтезирован и использован в качестве зонда для идентификации и выделения гена полипептида настоящего изобретения, т. е. Компонента В (Маниатис и др., см. выше). После того, как соответствующий олигонуклеотид, специфичный для Компонента В, будет отобран в соответствии с вышеописанным методом, он может быть синтезирован и гибридизирован с ДНК или, предпочтительно, с кДНК, происходящей от клеток, способных экспрессировать нужный ген,предпочтительно, после обогащения источника кДНК нужными последовательностями, например,путем экстракции РНК из клеток, продуцирующих высокие уровни нужного гена, и последующего превращения этой РНК в соответствующую кДНК с использованием обратной транскриптазы. Альтернативно, могут быть синтезированы подходящие олигонуклеотиды, специфичные для Компонента В и затем использованы в качестве праймеров для амплификации кДНК-фрагментов Компонента В с помощью РАСЕ-РС (М.А..,, , 1990). В частности, в соответствии с настоящим изобретением, сначала, для идентификации наиболее подходящего источника для мРНК Компонента В, осуществляли поиск соответствующих тканей человека и клеточных линий. Для этого скринировали ткани человека, происходящие из головного мозга, почек,печени, легких, сердца, поджелудочной железы,плаценты, селезенки, яичек, тимуса и матки, а также клеточные линии эпителиоидной карциномы, промиелоцитарного лейкоза, аденокарциномы молочной железы, лимфомы Беркита и миеломы. Скрининг осуществляли с помощью чувствительного анализа, основанного на полимеразноцепной реакции с использованием обратной транскриптазы (Т-РС). аилучшим источником мРК оказались ткани матки человека. Из этой ткани, с использованием метода быстрой амплификации, называемого быстрой 3- и 5 амплификацией кДНК-концов получали кДНКлоны Компонента В. Затем ДНК-молекулы, кодирующие Компонент В, и полученные вышеуказанным методом, вводят в экспрессирующие векторы с использованием известной техники (Маниатис и др., см. выше). Двухспиральную кДНК лигируют в плазмидные векторы с помощью, например, метода, в котором используются синтетические ДНК-адапторы, или с помощью 4 метода, в котором проводится связывание по тупым концам. Для экспрессии целевого белка экспрессирующий вектор должен также включать в себя специфические нуклеотидные последовательности, содержащие информацию, необходимую для регулирования транскрипции и трансляции ДНК, кодирующей нужный белок так, чтобы могли осуществляться экспрессия нужного гена и продуцирование белка. Сначала, для того, чтобы осуществлялась транскрипция нужного гена, перед этим геном должен быть помещен промотор, который может распознаваться РНКполимеразой и с которым эта полимераза связывается, способствуя, тем самым инициации транскрипции. Многие из известных промоторов, работающих с различной степенью эффективности (сильные промоторы и слабые промоторы), подразделяются на промоторы, используемые в прокариотических клетках, и на промоторы, используемые в эукариотических клетках. Промоторы, которые используются в настоящем изобретении, могут быть конститутивными (нерегулируемыми) промоторами, например, такими, как промоторлямбда-бактериофага, промоторгена (-лактамазы в 322, и промоторгена хлорамфеникол-ацетилтрансферазы рР 325 и т. п. или индуцибельными промоторами, например, такими, как промоторы прокариотов, например, правый и левый главные промоторы лямбда-бактериофага ( и Р), промоторы ,,,, и. о или гибридный промотор и т. п. ( , . . , 1277-282 (1987. Для гарантии эффективной трансляции мРНК необходимо, чтобы вместе с сильными промоторами, способными к продуцированию очень больших количеств мРНК, обеспечивающих высокие уровни экспрессии гена в прокариотических клетках, использовались также сайты связывания с рибосомами. В качестве примера могут служить последовательности - , помещенные на соответствующем расстоянии от инициирующего кодона. Для эукариотических клеток-хозяев могут быть использованы различные последовательности, регулирующие транскрипцию и трансляцию, в зависимости от природы конкретного хозяина. Эти последовательности могут происходить от вирусных источников, таких, как аденовирус, вирус папиломы, обезьяний вирус или т. п., где сигналы регуляции ассоциируются со специфическим геном,имеющим высокий уровень экспрессии. В качестве призеров могут служить промотор ТК вируса герпеса, промотор вируса 40, промотор гена а 14 дрожжей и т. п. Сигналы инициации транскрипции могут быть выбраны таким образом, чтобы при индуцировании супрессии или активации можно было соответствующим образом модулировать экспрессию генов. Затем ДНК-молекулу, содержащую нуклеотидную последовательность, кодирующую Компонент В 13088 настоящего изобретения, вместе с сигнальными последовательностями, регулирующими транскрипцию и трансляцию, вводят в вектор, который способен интегрировать последовательности целевого гена в хромосоме клетки-хозяина. Клетки, несущие в своих хромосомах введенную ДНК, могут быть отобраны путем введения одного или нескольких маркеров, позволяющих выбрать клетки, которые содержат экспрессирующий вектор. Такие маркеры могут сообщать клеткам, например,резистентность к антибиотикам или к тяжелым металлам (таким, как медь). Селективный ген может быть непосредственно связан с ДНК-последовательностями, которые должны быть экспрессированы, или он может быть введен в саму клетку путем констрасфекции. Для осуществления более высокой степени экспрессии гена может оказаться необходимым также присутствие других элементов. Такими элементами могут быть, например, энхансеры транскрипции, сигналы терминации транскрипции и интроны. Экспрессирующие векторы, которые содержат такие элементы, описаны., .. 3280 (1983). При выборе конкретного плазмидного или вирусного вектора должны учитываться следующие факторы легкость обнаружения клеток, содержащих данный вектор, т. е. эти клетки должны быть легко отделены от клеток, не содержащих этого вектора число копий векторов, которые желательно получить в данном конкретном хозяине, и возможность или невозможность перенесения вектора среди различных клеток-хозяев. Предпочтительными прокариотическими векторами являются плазмиды, способные реплицироваться в Е. , например, такие, как р 322, , 101, рАСУС 184 и т. п. ( . и др., м. выше), плазмиды В, например, такие как рС 194, рС 221, рТ 127, и т. п. ( ,, ,307-329 (1982, плазмиды , например,такие, как 101 ( .,. 169.4177-83), плазмиды(. 33729-742). Предпочтительными эукариотическими векторами являются например, ,40, бакуловирус и т. п. или их производные. Указанные векторы известны специалистам ( ..,(1980. Полученный экспрессирующий вектор вводят в соответствующую хозяйскую клетку стандартными методами, такими, как трансформация, трансфекция, липофекция, конъюгация, слияние протопла стов, электропорация, осаждение фосфатом кальция,прямое микроинъецирование и т. п. В целях настоящего изобретения могут быть использованы прокариотические или эукариотические клетки-хозяева. Предпочтительными прокариотами являются бактерии, такие, как Е. , , ,и т. п. Особенно предпочтительной является Е. , например, штамм 294 .2 (АТСС 314446) или Е.1776 (АТСС 31537), Е.3110 (, лямбда, АТСС 27325). Предпочтительными эукариотическими клетками-хозяевами являются клетки млекопитающих,например, клетки человека, обезьяны, мыши или хомяка (СНО, клетки яичника китайского хомячка),поскольку эти клетки обеспечивают посттрансляционную модификацию белковых молекул, например,правильную укладку и гликозилирование в нужных положениях. В целях настоящего изобретения могут быть также использованы дрожжевые клетки. Благодаря имеющейся в настоящее время различной технике рекомбинантных ДНК, в которой используются последовательности сильных промоторов и большое число копий плазмид, нужный белок может быть продуцирован и в дрожжах. После введения вектора в хозяйские клетки эти клетки культивируют в среде, способствующей селективному росту клеток, содержащих указанный вектор. Экспрессия клонированной ДНК-последовательности обеспечивает продуцирование Компонента В, его мутанта или фрагмента. Продуцированный таким образом белок выделяют или очищают традиционными методами, например, путем экстракции,осаждения, хроматографии, электрофореза и т. п. или путем аффинной хроматографии с использованием антител против Компонента В, иммобилизованных на колонке с гелем. Компонент В может быть также продуцирован как белок, секретируемый из молока трансгенных млекопитающих. В еще одном своем варианте, настоящее изобретения относится к использованию Компонента В, его солей, функциональных производных, предшественников или активных фракций в качестве лекарственного средства. В частности, Компонент В обладает противовоспалительными, антиокагулирующими и противоопухолевыми свойствами. Кроме того, Компонент В может быть использован для лечения патологий,связанных с изменением уровней Т-альфа (фактора роста Т-клеток), например, поведенческих и гормональных расстройств, антигенеза и т. п. На практике было показано, что Компонент В ингибирует свяэывание -альфа с его рецептором с константой аффинности,составляющей К 0,7710-10 М и измеренной путем вытеснения 1125 - -альфа из его рецептора, полученного из мембраны клеток А 431. 13088 Настоящее изобретение также относится к фармацевтическим композициям, содержащим терапевтически активное количество Компонента В в комбинации с фармацевтически приемлемыми наполнителям или разбавителями. Такие композиции могут быть получены для перорального, ректального, интраназального и предпочтительно для парентерального введения. Кроме того, в соответствии с настоящим изобретением, Компонент В может быть использован для местного применения. Композиции настоящего изобретения могут быть также изготовлены в виде форм с пролонгированным высвобождением, например, в виде подкожных имплантатов, полученных на основе липосом или микрокапсул сополимеров молочной и гликолевой кислот. Другие варианты осуществления настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения на конкретных примерах. Пример 1 Способ получения Компонента В из мочи человека Получение и очистка Компонента В из мочи человека полностью проиллюстрированы на фиг. 1. а) Стадия 1 К исходному материалу, представляющему собой мочу человека, добавляли соляную кислоту до тех пор, пока рН не становился равным 3,0. После декантирования осадка к моче (10 г/1 л исходной мочи) добавляли каолин. Полученную суспензию оставляли на 16 часов, а затем центрифугировали. После удаления супернатанта каолин экстрагировали аммиаком 2 М при Н 11,0. рН аммиачного элюата доводили до 8,0 и концентрировали с помощью мембранной ультрафильтрации (отрезок 1000 Да). Всю эту процедуру осуществляли при температуре 4 С.) Стадия 2 К раствору стадии (а) добавляли уксусную кислоту до тех пор, пока рН не становился равным 4,0, а затем добавляли смолу 70, предварительно уравновешенную в ацетатном буфере при рН 4,0. Полученный раствор оставляли для перемешивания на 4 часа, а затем фильтровали на фильтрепрессе. Адсорбированный материал элюировали из смолы Во 70 использованием аммиака при рН 9,0. Хроматографический элюат концентрировали с помощью мембранной ультрафильтрации (отрезок 1000 Да). Всю эту процедуру осуществляли при температуре 4 С. с) Стадия 3 Материал стадии , уравновешенный в ацетатном буфере, при р 5,6, адсорбировали на ионооб 6 менной смоле, подобной ЕАЕ-Сефарозе, предварительно уравновешенной при рН 5,6. После адсорбции элюирование осуществляли с использованием аммоний-ацетатного буфера 0,5 М при р 5,6. Затем роматографический элюат концентрировали с помощью мембранной ультрафильтрации (отрезок 1000 Да). Всю эту процедуру осуществляли при 4 С.) Стадия 4 Материал стадии (с) уравновешивали в ацетатном буфере при рН 4,5 и адсорбировали на ионообменной смоле, подобной СМ-Сефарозе и предварительно уравновешенной при рН 4,5. После завершения адсорбции элюирование осуществляли аммоний-ацетатным буфером 0,15 М при рН 4,5. Хроматографический элюат концентрировали с помощью мембранной ультрафильтрации (отрезок 1000 Да). Всю эту процедуру осуществляли при температуре 4 С. е) Стадия 5 Материал стадииочищали при температуре 25 С с помощью обращенно-фазовой жидкостной хроматографии высокого разрешения на смоле 18,уравновешенной в аммоний-ацетатном буфере 0,05 М при рН 5,6. Адсорбированный материал элюировали из смолы с использованием раствора ацетата аммония,содержащего 30(об/об) ацетонитрил. Хроматографический элюат концентрировали путем дистилляции (40 ) в вакууме.) Стадия 6 Материал стадии (е) очищали с использованием ионообменной смолы, подобной Е-52 и уравновешенной в аммоний-ацетатном буфере 0,02 М при рН 5,6. Элюирование адсорбированного материала осуществляли с использованием 0,25 М буфера. Концентрирование осуществляли с помощью мембранной ультрафильтрации (отрезок 1000 Да). Всю эту процедуру проводили при температуре 4 С.) Стадия 7 Материал стадииочищали на колонке, предварительно упакованной ионообменной смолой, подобной - (отвержденной с помощью) и уравновешенной при рН 6,2 в 20 мМ буферном растворе ацетата натрия (буфер А). Элюирование абсорбированного материала осуществляли градиентом от 100 буфера А до 100 буферного раствора ацетата натрия, содержащего 1 М(при рН 6,2).) Стадия 8 Материал стадииочищали с помощью обращенно-фазовой жидкостной хроматографии высокого разрешения на смоле 18 при температуре 25 С. После завершения адсорбции элюирование осуществляли линейным градиентом смеси водного раствора 0,1 трифторуксусной кислоты и ацетонитрила, подкисленного 0,1 трифторуксусной кислотой. 13088 Хроматографический элюат концентрировали путем дистилляции (45 С) в вакууме и лиофилизовали.) Стадия 9 Повторяли стадию 7. В результате этой процедуры получали конечный продукт, Компонент В, в виде аморфного белого порошка. Пример 2 Аналитическая характеризация Компонента В В целях определения основных физикохимических характеристик Компонента В полученный очищенный материал из мочи человека подвергали следующей аналитической обработке. а) Аминокислотная последовательность Аминокислотную последовательность Компонента В определяли в соответствии с методом Эдмана. Анализ осуществляли с использованием секвенатора, модель 477 А в соответствии с инструкцией изготовителя. Указанный анализ дает возможность идентифицировать аминокислотную последовательность Компонента В с 81 аминокислотными остатками, приведенными в 1.) Определение молекулярной массы Анализ осуществляли с помощью массспектроскопии электронным ударом (МС-ЭД), в результате чего было установлено, что молекулярная масса составляет 8937,9 Да. Этот анализ выявил пять дисульфидных мостиков и остаток в 80 Да, относящийся к группе О 4, связанной с Ту (39). Пример 3 Выделение геномной ДНК Компонента В человека Библиотека геномной ДНК человека в лямбдафаговом векторе -3 6/7 поставлялась фирмой(кат.1067, .1221). Геномную ДНК экстрагировали из плаценты человека и частично переваривали ферментом 3. Перед клонированием в -сайт вектора МВ-3 6/7 ДНК-фрагменты выделяли с исполъзованием градиента сахарозы с получением фрагментов размером от 8 до 22 К. Среда для культивирования Клетки Е.К 802, поставляемые фирмой(кат.С 1004-1) культивировали в среде, дополненной 10 мМ 4 и 0,2 мальтозой (среда для культивирования). Фаговую библиотеку разводили в 0,1 М 8 мМ 4, 50 мМ Трис-С 1 (рН 7,5) и 0,01 желатине . ДНК-библиотеку культивировали на -чашках с 1,5 агаром. Верхняя агароза для культивирования библиотеки содержала 0,136 М , 0,6 агарозу и 1 триптон ( кат.7213). Реагенты для гибридизации 20 х( кат.1096176). 3 х, 0,1,мочевина, при различных концентрациях,в зависимости от типа зонда (см. ниже). 1 х, 0,1 Система детекции Гибриды -олиго/ДНК обнаруживали с помощью -набора и экспонировали с пленкой(от фирмы , кат.РРМ 2106 и 2104, соответственно). 32 Р-Олигозондированные фильтры обнаруживали путем экспонирования с пленкой - (-, , кат.10). Олигонуклеотиды Олигонуклеотиды синтезировали с помощью автоматического синтезатора ДНК (мод. 392). Олигонуклеотиды очищали с помощью кассет ОРС (кат.400771) или с помощью электрофореза в денатурирующем полиакриламидном геле (ПААГ). Олигонуклеотиды СВ 1, СВ 2 и СВЕХ 2, используемые в качестве зондов, модифицировали с помощью аминомодификатора ММТ-С 12 ( кат.5206-1) в процедуре последнего цикла синтеза. Пероксидазу хрена (,кат.814393) конъюгировали с модифицированным олигонуклеотидом в соответствии с описанием (. . . 16, 4937, 1988), используя 1,4 фенилендиизотиоцианат ( кат.25855-5) в качестве гомобифункционального кросслинкера.-Олигонуклеотидные зонды очищали с помощью анионообменной хроматографии высокого разрешения (ВЖХР) на колонке с-100( кат.043010). Затем осуществляли элюирование 20 мМ буферным раствором фосфата натрия при рН 6,0 и линейным градиентом хлорида натрия (от 0,2 до 1, 0 М) в течение 30 минут. Очищенные -олигонуклеотиды концентрировали с помощью 10, промывали фосфатнобуферным раствором (РВ) и хранили в темноте при 4 С. Концентрацию -олигонуклеотида вычисляли при ОП 403 (40389,5 см-1 х мМ-1). Затем синтезировали следующие олигонуклеотиды 1 5 1 5 2 5 1 5 2 5 3 5 5 5 42 5 1 5 2 5 1 52 5 4 5 4 5 41 5 41 5 где -, - и . Титрование библиотеки Геномную ДНК-библиотеку человека титровали в соответствии со стандартными (, ,) путем инфицирования 0,3 мл культуры клеток .802, выдержанной в течение ночи, различными разведениями библиотеки, в пределах от 2 х 10-3 до 2 х 10-7. Смесь клеток библиотеки инкубировали при комнатной температуре в течение 20 минут, а затем в течение 10 минут смесь инкубировали при 37 С. Инфицированные клетки смешивали с 4 миллилитрами верхней агарозы, предварительно нагретой при температуре 50 С, а затем выливали в 10 см-планшеты с агаром, предварительно нагретом при 37 С. Эти планшеты инкубировали в течение ночи при температуре 37 С. Число бляшек подсчитывали в каждом планшете. Планшеты с дубликатами культуры получали для каждого титра библиотеки. Как это ожидалось, титр геномной ДНК-библиотеки составлял 5 х 109 БОЕ/мл. Скринирование библиотеки Клетки .К 802 культивировали в течение ночи при температуре 37 С. 0,6 мл клеточной культуры инфицировали аликвотой библиотеки(6 х 104 БОЕ), суспендированной с СМ. Инфицирование и культивирование осуществляли вышеописанным способом за исключением того, что использовали 9 мл верхней агарозы и 15 см-планшеты. Полуконфлюэнтные бляшки переносили на найлоновую мембранув соответствии с инструкцией руководства фирмы. Блотированные ДНК денатурировали путем наложения фильтров колониями кверху на фильтровальную бумагу, пропитанную 1,5 М-хлоридом натрия и 0,5 М-гидроксидом натрия, на 7 минут. Затем блотированные ДНК нейтрализовали путем наложения фильтров на фильтровальную бумагу, пропитанную нейтрализующим раствором (1,5 М 8, 0,5 М Трис-С 1 (рН 7,2), 1 мМ ЭДТА (в каждом случае, 2 х 3 мин). Фильтры промывали в 2 х и осушали воздухом. ДНК закрепляли на мембране путем наложения фильтров на фильтровальную бумагу, погруженную в 0,4 Мна 20 минут. После этого фильтры промывали в 5 х в течение одной минуты, а затем хранили в полиэтиленовом мешке при 4 С вплоть до гибридизации. Человеческую геномную ДНК-библиотеку (1 х 106 клонов) скринировали с высокой плотностью с использованием олигонуклеотидных зондов -2. Затем были выбраны 20 положительных клонов. Шесть положительных клонов повторно скринировали с использованием олигонуклеотидного зонда-1 и олигонуклеотидного зонда -2. Три клона, обозначенные 4, 12 и 15, были подтверждены как положительные в отношении гена Компонента В. Гибридизация Фильтры предварительно инкубировали в течение 30 минут при 42 С в гибридизирующем растворе, а затем гибридизировали с использованием соответствующего олигонуклеотидного зонда(5 нг/мл олигонуклеотидной части в гибридизирующем растворе) при температуре 42 С в течение 45 минут, наконец, дважды промывали (по 15 минут каждый) при температуре 42 С в промывающем растворе, содержащем мочевину в соответствующей концентрации (см. ниже). Затем фильтры промывали в 2 х при комнатной температуре, а гибридизированные бляшки обнаруживали с помощью -реагентов и экспонировали с пленкойв течение 60 минут. Для минимизации неспецифической гибридизации с .и ДНК лямбда-фага были экспериментально определены условия промывки олигозондированных фильтров. Серийные разведения в пределах от 500 до 15 аттомолей целевой ДНК были нанесены пятнами на мембранув присутствии ДНК лямбда-фага (10 нг). ДНК лямбдафага и ДНК .(10 нг каждая) были использованы в качестве негативного контроля. После этого получали несколько полосок и использовали их в экспериментах для гибридизации с использованием 5 нг/мл олигонуклеотидного зонда. Промывку осуществляли с использованием промывочного раствора А, содержащего 0, 9, 18, 27 и 36 -ную мочевину. 182 и 27 мочевина оказалась эффективной для СВ 1 и СВ 2, соответственно. Фильтры, гибридизированные с использованием 2, промывки промывочным раствором А, содержащим 18 мочевину. Гибридизацию с использованием 32 Р-олигонуклеотида СВЕХ 4 осуществляли при 50 С, а фильтры промывали в промывочном растворе В при температуре 45 С. Субкринировние бляшек Позитивные колонии собирали в Пастеровскую пипетку и переносили в сосуд, содержащий 1 мл СМ 1 каплю хлороформа. После 2-часовой инкубации при встряхивании при комнатной температуре суспензия фага хранилась при 4 С. Разведенные в 10-3 суспензии фага наносили на 10 см-платы и раскринировали на двух повторяющихся фильтрах с двумя олигозондами, т. е. один используется в первом скрининге, а другой соответствует примыкающему району Компонента В. Независимые клоны, позитивные с обоими зондами, были отобраны и ресуспендированы, как указано выше. Приготовление фаговых стоков Позитивные клоны были размножены инфекцией клеток Е.К 802 и выращиванием на 15 смагаровых платах. После инкубации в срезепри 37 С сливающийся лизат был собран с агаровых плат с использованием 10 мл . Были добавлены несколько капель хлороформа, клеточный дебрис удален центрифугированием при 3000 об/мин при 4 С, и прозрачный спернатант, содержащий фаг,был перенесен в 50 глицерин, разлит на части и заморожен при -80 С. Экстракция фаговой ДНК 2 х 109 клеток .К 802 были инфицированы отобранным фаговым клоном (соотношение клетка/фаг 41) и выращены в 100 мл жидкой культуральной средыпри 37 С. В конце инкубации осуществлялся полный лизис клеток добавлением к культуре хлороформа 5 мкл/мл. Фаговая ДНК экстрагировалась с помощьюпо инструкции изготовителя. Секвенирование фаговой ДНК Фаговая ДНК была секвенирована с помощью циклического секвенирующего набора от(.401388) с автоматическим секвенатором ДНК (мод. 373 А). ДНК фага экстрагировали из клонов 4, 12 и 15 и секвенировали циклами. Праймеры для секвенирования подбирали либо исходя из аминокислотной последовательности Компонента В (1, 2, СВР 1, СВР 2), либо исходя из данных секвенирования кДНК или геномной ДНК. Данные секвенирования указывали на три клона, содержащих полную длину гена Компонента В. Анализ рестрикции фаговой ДНК Фаговую ДНК подвергали однократному или многократному перевариванию рестректирующим ферментом. ДНК-фрагменты разделяли с помощью электрофореза на 0,6 агарозном геле, а затем блотировали на мембрану. Фильтры повторно зондировали с использованием олигонуклеотидов СВЕХ 2, 2 и 4, соответствующих экзонам 1, 2 и 3, соответственно. Субклонирование гена Компонента В в 11 Рестрикционный анализ клона 4 Компонента В,проведенный с использованием ферментов 1,1 и 1, и Саузернблот-анализ, проведенный с использованием олигонуклеотидных зондов, специфичных для трех экзонов Компонента В, обнаруживали наличие полного гена Компонента В, содержащего 5,21-фермент (фиг. 5). Фаговую ДНК экстрагировали из клона 4 и переваривали ферментом 1. Полученные ДНКфрагменты разделяли с помощью электрофореза на агарозном геле. 5,2 -фрагмент очищали с помощью( кат.20020) и лигировали в 1-линеаризованный( кат.212207). Штамм .1( кат.200268) трансформировали с использованием лигирующей смеси, а трансформированные клетки отбирали на Ар/Тс-чашках. Как показал рестрикционный анализ, с использованием фермента 1 был выделен один клон, содержащий нужную плазмиду, который был назван 4. Затем осуществляли рестрикционный анализ с использованием , , , , , , , , , , , ,2, , ,и . Кроме того, осуществляли Саузерн-блот-анализ с использованием олигонуклеотидных зондов, специфичных для Компонента В и плазмиды 4 после однократного и двойного переваривания. На фиг. 6 показана рестрикционная карта плазмиды 4. На фиг. 4 показана рестрикционная карта гена Компонента В. Ген Компонента В содержит 3 экзона, разделенные друг от друга двумя интронами. Эти экзоны фланкированы соответствующими сайтами. Экзон 1, имеющий длину 84 п.о., содержит 26 нуклеотидов нетранслированной мРНК и последовательность, кодирующую 19 аминокислот предполагаемого сигнального пептида. Этот экзон отделен от экзона 2 интроном, длина которого составляет 410 п.о. 13088 Экзон 2, имеющий длину 120 п.о., кодирует 3 аминокислоты предполагаемого сигнального пептида и 37 аминокислот зрелого белка. Этот экзон отделен от экзона 3 интроном, длина которого составляет около 550 п.о. Экзон 3, имеющий длину 326 п.о., кодирует Сконцевые 44 аминокислоты Компонента В и содержит 192 нуклеотида нетранслируемой мРНК, которая имеет сигнал полиаденилировния (ТАТААА),расположенный на расстоянии 14 п.о. (вверх по течению) от сайта 3-процессинга, к концу которого добавляется уА-хвост. В частности, было установлено, что в трех геномных клонах последовательность, кодирующая сигнальный пептид, содержит кодонв положениипредполагаемого сигнального пептида. Было установлено, что аминокислотная последовательность Компонента В, продуцированная геномным геном, идентичная последовательности, экспериментально определенной методом расщепления по Эдману. Анализ последовательности, расположенной перед экзоном 1, выявил промоторную область (фиг. 3), содержащую ТАТА-блок (в - 28), и различные,расположенные вверх по течению элементы промотора и энхансеры, включая -богатый участок в-58, АР-1-сайт в -83, АР-2-сайт в -360 и несколько Е-блоков. ТАТА-блок является предпочтительным сайтом связывания для инициации транскрипции фактора. -богатый участок представляет собой сайт связывания для -1, главного фактора транскрипции, участвующего в транскрипции широкого ряда генов (.,, 1988). АР-1-сайт является сайтом связывания для АР-1,комплекса факторов транскрипции, образованного с и -. АР-1-сайт присутствует в нескольких генах, ответственных за рост и дифференцировку клеток. АР-1 является одним из нескольких элементов, опосредующих ответную реакцию по отношению к активаторам протеинкиназы С (с .. , 1991). АР-2-сайт является мишенью для АР-2, фактора транскрипции, активированного РМА и АМР. Е-блоки являются обобщающими последовательностями, обнаруженными в нескольких энхансерных областях, и играют важную роль для определения тканеспецифической экспрессии генов. Е-блок содержит последовательность СА, где два основания, расположенные в середине, могут меняться для каждого конкретного Е-блока (. 1989, 1, 1081-1087). Промотор Компонента В содержит потенцильный восприимчивый элемент для рецептора фактора глюкокортикоидной реакции , что указывает на то, что ген Компонента В может быть индуцирован глюкокортикоидами. 10 Субклонировние гена Компонента В в вектор для экспрессии в клетках млекопитающих Известно, что продуцирование -блоков в клетках млекопитающих может быть увеличено благодаря присутствию интронов. Геномная ДНК Компонента В может быть экспрессирована в клетках млекопитающих. Для этого 1364 п.о. - фрагмент, простирающийся от 50 до 1413 гена Компонента В, вырезали из плазмиды 4 путем переваривания ферментамии . На фиг. 2 показана рестрикционная карта транскриптона Компонента В, гдеи-сайты расположены по концам. Полный ген Компонента В восстанавливали путем лигирования этого фрагмента с синтетическим олигонуклеотидом, воспроизводящим 5-конец гена, фланкированного соответствующим рестрикционным сайтом для последующего клонирования гена в эукариотической экспрессирующей плазмиде. Пример 4. Выделение кДНК-клонов Компонента В Для получения частичных кДНК-клонов, соответствующих 5- и 3-концам мРНК Компонента В,использовали способ быстрой амплификации кДНКконцов, описанной. (1988) . .. .,85 8998. Частичные клоны содержат перекрывающуюся ДНК-последовательность, а поэтому они могут быть использованы для конструирования полной кДНК-последовательности Компонента В. Схема, иллюстрирующая общую стратегию для -клонирования, показана на фиг. 7. В 3-, ДНК-последовательность второго экзона гена Компонента В использовали для конструирования геномного специфического праймера СКСВ (5-ТСААСТССТАСАССТССААССАС-3)(21). Синтез кДНК инициировали отА-концаА РНК матки человека с использованием в качестве праймера олигонуклеотид 5-3 (24), называемый адапторным праймером АР. КДНК использовали в качестве матрицы для полимеразно-цепной реакции , где в качестве праймеров использовали СКСВ 1 и АР, которые продуцировали фрагмент, имеющий приблизительно 450 п.о., и соответствующий 3-концу кДНК Компонента В. В 5-, из ДНК-последовательности 450 п.о. 3-РАСЕ-фрагмента конструировали праймер СКСВ 7 (53) (22), который использовали в качестве праймера для синтеза кДНК изА РНК матки человека. После очистки в целях удаления мРНК и праймера СКСВ 7 конец олигодезоксицитидина добавляли к 3 концу кДНК. Эту дДНК с хвостом использовли в качестве матрицы в , где в качестве праймеров служили гнездовой праймер СКСВ 2 (5-3) (23) и якорный праймер(,53) (26). СКСВ 2 гибридизировали с 3 концов последовательности второго экзона, а АСР гибридизировали с олигодезоксицитидиновым хвостом. В результате получали фрагмент приблизительно в 230 п.о., который содержал ДНКпоследовательность, соответствующую 5-концу мРНК Компонента В. Используемые общие схемы эксперимента (например, электрофорез в полиакриламидном геле,осаждение этанолом, лигирование и переваривание рестриктирующими эндонуклеазами), бактериальные культуральные среды (например, ) и химические растворы (например, фенол) подробно описаны., (1989),.,,, если это не указано особо. Процедуры 3 -клонирования 3 -система для быстрой амплификации кДНК-концов была закуплена у,.,. ,А- РНК матки человека закупали у, .,, . Синтез первой нити кДНК осуществляли с использованием протокола и реагентов, поставляемых вместе с 3 системой. Для этого 1 мкл (1 мкг)А-РНК матки объединяли с 1 мкл 10 мкМ раствора АР и 12 мкл воды, обработанной диэтилпирокарбонатом , и полученную смесь нагревали 10 минут до 65 С. После охлаждения смеси на льду реакционные компоненты добавляли так, чтобы конечная композиция имела приблизительно следующий состав 20 мМ Трис-НС (рН 8,4, 50 мМ КС,2,5 мМ 2, 100 мкг-мл альбумина бычьей сыворотки, 500 нМ АР, 500 мкМ каждого из и , и 50 нг/мкл РНК, в объеме 19 мкл). Рекционную смесь нагревали до 42 С, а затем добавляли 1 мкл (20 ед) обратной транскрипции. После 30-минутного инкубирования при 42 С реакционную смесь охлаждали на льду и добавляли 1 мкл (2 ед.) РНК-азы . Затем проводили РНК-аза -переваривание в течение 10 минут при 42 С. Полученную реакционную смесь хранили при -20 С вплоть до осуществления . Для осуществлениябыли получены четыре идентичные смеси (40 мкл), каждая из которых имела следующий состав 1 мклкДНК матки в 40 мМ К, 70 мМ Трис-НС (рН 8,8) 0,1 Тритон Х-100, 1 мМ 2, 0,25 мкМ СКСВ 1 и 0,5 мкМ АР. Реагенты из 3 системы не использовались для . СКСВ 1- и АР-праймеры синтезировали на олигонуклеотидном синтезаторе модели 392( , .). После разблокирования,лиофилизации и ресуспендирования в обработанной воде измеряли оптическую плотность каждого раствора при длине волны 260 нм. Исходя из измерений оптической плотности, в обработанной воде приготавливали 10 мкМ-раствор каждого из олигонуклеотидов. Неочищенные олигонуклеотидные растворы использовали для реакции без дополнительной очистки. Концентрацию неочищенного АР, который давал результаты,идентичные результатам, полученным с использованием 3 -системы, определяли экспериментально 0,4 мкМ неочищенного АР эквивалентны 0,2 мкМ АР, закупленного удля-реакции. 40 мкл -реакционной смеси нагревали в термоячейке до температуры 94 С, а затем к каждой смеси добавляли 10 мкл смеси, содержащей следующие компоненты 1,25 ед ДНК-полимеразы(, , ), 40 мМ КС, 70 мМ Трис- (рН 8,8), 0,1 Тритон-Х-100,1 мМ 2 и 1 мМ каждого из , ,и . Конечная концентрация каждого реагента в РСР составляла приблизительно 1 мкл кДНК матки на 50 мкл, 1,25 ед. ДНК-полимеразына 50 мкл 40 мМ , 70 мМ Трис (рН 8,8), 0,1 Тритона Х-100, 1 мМ 2, 0,2 мкМ СКСВ 1,0,4 мкМ АР и 0,2 каждого из , ,и. После завершения 5-минутного инкубирования при 94 С осуществляли программу термоциклическойв соответствии с описанием,,,. (1991) .. 19, 4008, варьируя температуру отжига от 73 до 63 С. После -амплификации четыре реакционных смеси объединяли и ДНК-продукты фракционировали по размерам с помощью электрофореза на 5 полиакриламидном геле. ДНК-продукт, имеющий длину приблизительно 450 п.о., вырезали из геля и очищали путем электроэлюирования в диализной трубке. Элюат экстрагировали смесью фенола и хлороформа (5050 об/об), осаждали этанолом, осушали и ресуспендировали в 10 мкл стерильной воды. Вследствие независимой от матрицы концевой трансферазной активности ДНК-полимеразыи ее в высокой степени избирательности по отношению( (1988) .. 16,9677 и, , , (1989) .. 17, 3319), очищенный -фргмент в 450 п.о. имел, как и ожидалось, один дезоксиаденозиновый остаток у каждого 3-конца. Для субклонирования и характеризации -фрагмента получали Твектор(,, ) в соответствии с описаниеми др., (1991)(20 мкг) переваривали рестриктирующей эндонуклеазной , а затем очищали путем экстракции смесью (5050 об/об) фенола и хлороформа. После осаждения этанолом ДНК обрабатывали 9 единицами -ДНК-полимеразы в течение 2 часов при 70 С в 50 мкл реакции, содержащей 50 мМ ,10 мМ Трис- (рН 9,0), 0,1 Тритон-Х-100,1,5 мМ 2 и 2 мМ . После этого вектор снов очищали путем экстракции фенолом и хлороформом (5050 об/об) и осаждали этанолом. Резуль 11 13088 татом этой процедуры было добавление одиночного дезокситимидинового остатка к каждому 3-концу,что позволяло использовать этот вектор для инсерции ДНК-фрагментов, синтезированных посредством -ДНК-полимеразы. Нефосфорилированный -фрагмент в 450 п.о. вставляли в Т-вектор посредством реакции с ДНКдигазой Т 4 (, , ), используя условия, рекомендуемые изготовителем. Лигирующую реакционную смесь инкубировали приблизительно 72 часа при 16 С, а затем использовали для трансформации компетентных клеток- .(,, ). Трансформированные клетки высеивали на -агар, содержащий 50 мкг/мл ампициллина. Перед посевом клеток на поверхность агара каждой чашки наносили путем распыления 100 мкл 2 Х- (.,, ) и 40 мкл 100 мМ( . .,, ) и оставляли для осушки. После инкубирования в течение ночи при 37 С были видны колонии, окрашенные голубым пигментом, и неокрашенные колонии(белые). Из культур с 12 белыми колониями выделяли плазмидную ДНК. Все 12 изолятов содержали вставку в 450 п.о. Для последующего анализа выбирали 5 клонов 3 СВ 4, 3 СВ 6, 3 СВ 7, 3 СВ 8 и 3 СВ 9. Анализ ДНК-последовтельности проводили с использованием секвеназного набора 2,0 (, ,). Процедура 5 клонирования 5 систему для быстрой амплификации кДНК-концов закупали у. ., , .РНК матки человека закупали у,, . Эксперименты по 5 клонированию осуществляли с использованим протокола и реагентов, поставляемых вместе с 5 системой, за исключением того, что (а) СКСВ 7-, АСР- и -праймеры синтезировали на олигонуклеотидном синтезаторе модели 392,. . И использовали, как описано для 3 клонирования, итермоциклическую программу, описанную для 3 клонирования, использовали для кДНК-амплификации. Первую нить кДНК синтезировали следующим образом 1 мкл (1 мкг)А РНК матки объединяли с 0,5 мкл 10 мМ раствора СКСВ 7 и 13,5 мкл -обработанной воды, и полученную смесь нагревали при 70 С в течение 10 минут. После охлаждения смеси на льду добавляли ракционные компоненты так, чтобы конечный состав приблизительно содержал 20 нМ ТРИС-НС(рН 8,4) 50 мМ , 3 мМ 2, 10 мМ ,200 мМ СКСВ 7, 400 мкМ каждого из , , ии 40 нг/мкл РНК в объеме 24 мкл. Реакционную смесь нагревали до 42 С и добавляли 1 мкл (220 ед) обратной транскриптазы с. После 30-минутного инкубирования при 42 С и 15-минутного инкубирования при 70 С реакционную смесь помещали в условия 55 С и добавляли 12 1 мкл (2 ед) РНК-азы Н. Переваривание РНК-азойосуществляли в течение 10 минут при температуре 55 С. кДНК отделяли от неключенных , КСВ 7 и белков с использованием(входящего в 5 систему). В частности, 120 мкл раствора для связывания (6 М) добавляли к реакционной смеси первой нити и кДНК/-раствор переносили в центрифужную пробирку. После центрифугирования при 13000 хв течение 20 сек. добавляли 0,4 мл холодного (4 С) промывочного буфера. Затем центрифугировали еще 20 сек. при 13000 х . Эту стадию повторяли еще два раза. После двухкратной промывки 400 мкл холодного (4 С) 70 этанола,кДНК элюировали путем добавления в центрифужную пробирку 50 мкл стерилизованной дистиллированной воды, после чего центрифугировали еще 20 секунд при 13000 х . Гомополимерный хвост добавляли к 3-концу кДНК с использованием терминальной дезоксинуклеотидилтрансферазыи. Эту реакцию осуществляли в совместимом буфере. 10 мкл очищено кДНК объединяли с 7,5 мкл -обработанной воды, 2,5 мкл 10 х реакционного буфера, 1,5 мкл 25 мМ раствора 2 и 2,5 мкл 2 мМ раствора . Реакционную смесь инкубировали в течение 2-3 минут при 94 С. После охлаждения в течение 1 минуты на льду добавляли 1 мкл(10 ед./мкл), Конечная смесь имела следующий состав 10 мкл кДНК в 20 мМ Трис- (рН 8,4), 50 мМ , 1,5 мМ 2,200 мкМ , 0,4 ед./мкл . Реакционную смесь инкубировали в течение 10 минут при 37 С, а затем в течение 10 минут при 70 С для инактивации . Для осуществлениябыли приготовлены четыре различные реакционные смеси, имеющие следующие конечные концентрации праймера (на 50 мкл) 1. 400 нМ АСР 2. 800 нМ АСР 3. 360 нМи 40 нМ АСР (91) 4. 720 нМи 80 нМ АСР (91). Конечные концентрации (на 50 мкл) остальных компонентов во всех четырех реакциях были идентичными 5 мкл-концевой кДНК в 20 мМ Трис- (рН 8,4) 50 мМ 1,5 мМ 2 400 нМ СКСВ 2 и 200 мкМ каждого из , , и . Компоненты, включая АСР- и праймеры, смешивали в первоначальном объеме 45 мкл и нагревали до С в термоячейке. Затем к каждой реакции добавляли 5 мкл смеси 1,25 ед. ДНК-полимеразы( ) в 20 мМ Трис- (рН 8,4) с доведением конечного объема до 50 мкл. Для амплификации 5-кДНК-фрагмента использовали программу термоциклической. После -амплификации все четыре реакционные смеси объединяли и ДНК-продукты фракционировали по размерам с помощью электрофореза на 8 полиакриламидном геле. ДНК-продукт, состав 13088 ляющий примерно 230 п.о., вырезали из геля, очищали и субклонировали в Т-вектор, как было описано выше для 3 фрагмента в 450 п.о. Для дальнейшего анализа выделяли 5 клонов 5 СВ 2,5 СВ 3, 5 СВ 5, 5 СВ 6, 5 СВ 11. Анализ ДНК-последовательности осуществляли с использованием секвеназного набора 2.0 (, , ). На фиг. 8 показана полная кДНКпоследовательность Компонента В, собранная из-клонов 5 СВ 3 и 3 СВ 7, в которой указываются рестрикционные сайты. Анализ первичных структур кДНК-последовательности клонов 5 СВ 3, 5 СВ 6, 5 СВ 11 и 3 СВ 4,3 СВ 7, 3 СВ 9 показал полное соответствие этих последовательностей экзону Компонента В (геномный клон 4 примера 3). Хотя настоящее изобретение описано выше на конкретных примерах его осуществления, однако специалистам в данной области очевидно, что в него могут быть внесены различные изменения и модификации, не выходящие за рамки существа и объема нижеследующей формулы изобретения. Надписи к рисункам Фиг. 1. Рабочая схема для очистки Компонента В из мочи. Фиг. 2. Рестрикционная карта геномного транскриптона Компонента В (геномная ДНК указанного Компонента В показана в 2). Стрелками показаны сайты сплайсинга. Фиг. 3. Последовательность области промотора Компонента В (область промотора указанного Компонента В показана в 2). Сайты связывания для факторов транскрипции АР-1, АР-2, -1 и Е-блоков указываются. Показаны также ТАТА-блок и . Фиг. 4. Рестрикционная карта гена Компонента В. Выведенная мРНК показана строкой ниже геномного гена области, обведенные в рамку, обозначают последовательность, кодирующую белок. Фиг. 5. Рестрикционная карта вставки клона 4. Фиг. 6. Рестрикционная карта плазмиды 4. Фиг. 7. Общая схема, используемая для клонирования ДНК-последовательности Компонента В. Фиг. 8. Полная кДНК-последовательность Компонента В, в которой указаны сайты рестрикции ЗаявительНазвание Улица 6 ГородСтранаНазвание изобретения Новый белок, называемый компонентом В Число последовательностей 26 Тип машинного считывания Тип носителя гибкий диск Компьютер РС, совместимый сОперационная система Программное обеспечение 1.25 Данные предыдущей заявки Номер заявки 92 /919 Дата подачи 221992 Тип молекулы ДНК (геномная) Дополнительная информация /Прим.-богатый блок представляет собой сайт связывания для фактора транскрипции -1 Дополнительная информация /функцияГлюкокортикоидный реактивный элемент стандартное название Дополнительная информация стандартное название сайт АР-1/ Прим.сайт АР-1 является сайтом связывания для фактора транскрипции АР-1 Дополнительная информация стандартное название сайт АР-2/ Прим.сайт АР-2 является сайтом связывания для фактора транскрипции АР-2 Отличительная особенность Название/Ключ сигнал Локализация(573634, 10401049) Дополнительная информация /функция предполагаемый сигнальный пептид Отличительная особенность Название/Ключ интрон Локализация(6361040, 11611686, 20132031) Описание последовательности 2 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полипептид, ингибирующий связывание альфа с его рецептором, характеризующийся аминокислотной последовательностью 1, или его соли карбоксильных групп и функциональных аминогрупп, обладающие такой же биологической активностью. 2. Лекарственное средство, обладающее противовоспалительной и/или антикоагулирующей, и/или противоопухолевой активностью, отличающееся тем, что оно содержит в своем составе полипептид по п. 1. 3. Способ получения полипептида по п. 1, отличающийся тем, что осуществляют а) адсорбцию мочи при кислотном рН на каолине и ее экстракцию аммиаком) элюирование фракции (а) на смоле 70 с использованием аммиака с) элюирование фракциина Сефарозной смоле с использованием ацетатного буфера) элюирование фракции (с) на СМ-Сефарозной смоле с использованием ацетатного буфера е) элюирование фракциина смолеС 18(ВЭЖХ) с использованием смеси ацетатного буфера и ацетонитрила(ВЭЖХ) с использованием смеси водной трифторуксусной кислоты и ацетонитрила) элюирование фракциина смоле - с использованием ацетатного буфера. 4. Способ по п. 3, отличающийся тем, что указанной мочой является моча человека. 5. Фрагмент ДНК, кодирующий полипептид по п. 1. 6. Фрагмент ДНК, кодирующий полипептид по п. 1 и способный гибридизоваться с фрагментом ДНК по п. 5. 7. Фрагмент ДНК, кодирующий полипептид по п. 1, характеризующийся нуклеотидной последовательностью 2. 8. Фрагмент ДНК, кодирующий полипептид по п. 1, характеризующийся нуклеотидной последовательностью 3. 9. Экспрессирующий вектор, включающий фрагмент ДНК по п. 5. 10. Экспрессирующий вектор, включающий фрагмент ДНК по п. 6. 11. Экспрессирующий вектор, включающий фрагмент ДНК по п. 7. 12. Экспрессирующий вектор, включающий фрагмент ДНК по п. 8. 13. Штамм . , трансформированный экспрессирующим вектором по п. 9 и продуцирующий полипептид по п. 1. 14. Штамм . , трансформированный экспрессирующим вектором по п. 10 и продуцирующий полипептид по п. 1. 13088 15. Штамм . , трансформированный экспрессирующим вектором по п. 11 и продуцирующий полипептид по п. 1. 16. Штамм ., трансформированный экспрессирующим вектором по п. 12 и продуцирующий полипептид по п. 1. 17. Способ получения полипептида по п. 1,включающий культивирование прокариотической или эукариотической клетки, отличающийся тем,что клетка трансформирована экспрессирующим вектором по любому из пп. 10-12. 18. Способ получения полипептида по п. 1,включающий культивирование прокариотической или эукариотической клетки, отличающийся тем,что клетка трансформирована экспрессирующим вектором по п. 9, содержащим фрагмент ДНК по п. 5. 19. В основном чистый белок, содержащий полипептид по п. 1 или его соли карбоксильных групп,или функциональных аминогрупп, обладающие такой же биологической активностью, полученный способом, включающим в себя следующие стадии а) адсорбцию мочи при кислотном рН на каолине и ее экстракцию аммиаком) элюирование фракции (а) на смоле 70 с использованием аммиака с) элюирование фракциина Сефарозной смоле с использованием ацетатного буфера) элюирование фракции (с) на СМ-Сефарозной смоле с использованием ацетатного буфера е) элюирование фракциина смолеС 18(ВЭЖХ) с использованием смеси ацетатного буфера и ацетонитрила(ВЭЖХ) с использованием смеси водной трифторуксусной кислоты и ацетонитрила) элюирование фракциина смоле - с использованием ацетатного буфера. 20. Фармацевтическая композиция, обладающая свойством ингибировать связывание -альфа(фактор роста Т-клеток), отличающаяся тем, что содержит терапевтически приемлемое количество полипептида по п. 1 в комбинации с одним или несколькими терапевтически приемлемыми наполнителями или разбавителями. 21. Фармацевтическая композиция, обладающая свойством ингибировать связывание -альфа(фактор роста Т-клеток), отличающаяся тем, что содержит терапевтически приемлемое количество в основном чистого белка по п. 19 в комбинации с одним или несколькими терапевтически приемлемыми наполнителями или разбавителями. Фиг. 1. Рабочая схема для очистки Компонента В Фиг. 2. Рестрикционная карта геномного транскриптона компонента В 13088 Фиг. 3. Последовательность области промотора Компонента В Фиг. 4. Рестрикционная карта гена Компонента В Клон 4 Фиг. 5. Рестрикционная карта вставки клона 4 Фиг. 6. Рестрикционная карта плазмиды рВ СВ 4
МПК / Метки
МПК: C07K 14/47, C12N 1/21, A61K 35/22, C12N 15/12
Метки: способ, средство, композиция, лекарственное, днк, экспрессирующий, e.coli, штамм, полипептид, полипептида, фармацевтическая, получения, фрагмент, варианты, вектор
Код ссылки
<a href="https://kz.patents.su/30-13088-polipeptid-lekarstvennoe-sredstvo-sposob-polucheniya-polipeptida-varianty-fragment-dnk-varianty-ekspressiruyushhijj-vektor-varianty-shtamm-ecoli-varianty-farmacevticheskaya-kompozi.html" rel="bookmark" title="База патентов Казахстана">Полипептид, лекарственное средство, способ получения полипептида (варианты), фрагмент ДНК (варианты), экспрессирующий вектор (варианты), штамм E.coli (варианты), фармацевтическая композиция (варианты)</a>