Изолированная нуклеотидная последовательность, вектор, растительная клетка, зрелое растение, способ высокоуровневого экспрессирования гетерологичного гена в растении и различных его тканях, конструкция нуклеиновой кислоты, способ использования конструкции нуклеиновой кислоты в качестве выбираемого маркера
Формула / Реферат
Настоящее изобретение относится к изолированным некодирующим нуклеотидным последовательностям, полезным в качестве промоторов для экспрессии гетерологичных генов у растений. Настоящее изобретение также относится к векторам и клеткам растений, включающим изолированные нуклеотидные последовательности. Для экспрессии интродуцированных генов на высоком уровне и в различных тканях растений используются AHAS промоторы из кукурузы. Были клонированы и секвенированы промоторы из alsl и als2 генов кукурузы, и регионы промоторов этих генов затем введены в плазмиду 5’ к гену-репортеру b-глюкуронидазы (GUS). Оба фрагмента промотора происходят из линии кукурузы XI 12. Фрагмент промотора alsl длиной приблизительно 1400 пар оснований, в то время как промотор als2 содержит 819 пар оснований.
Текст
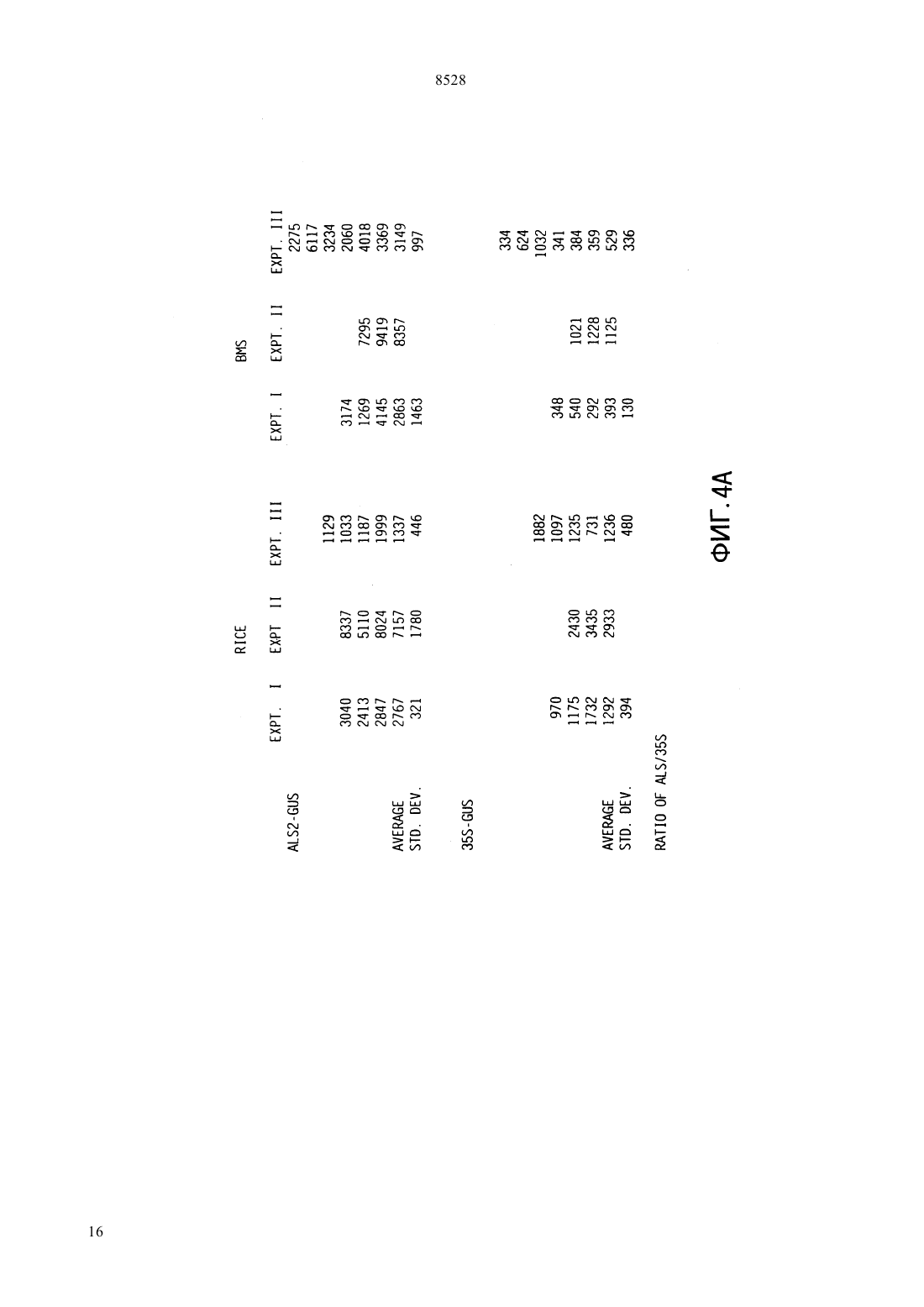
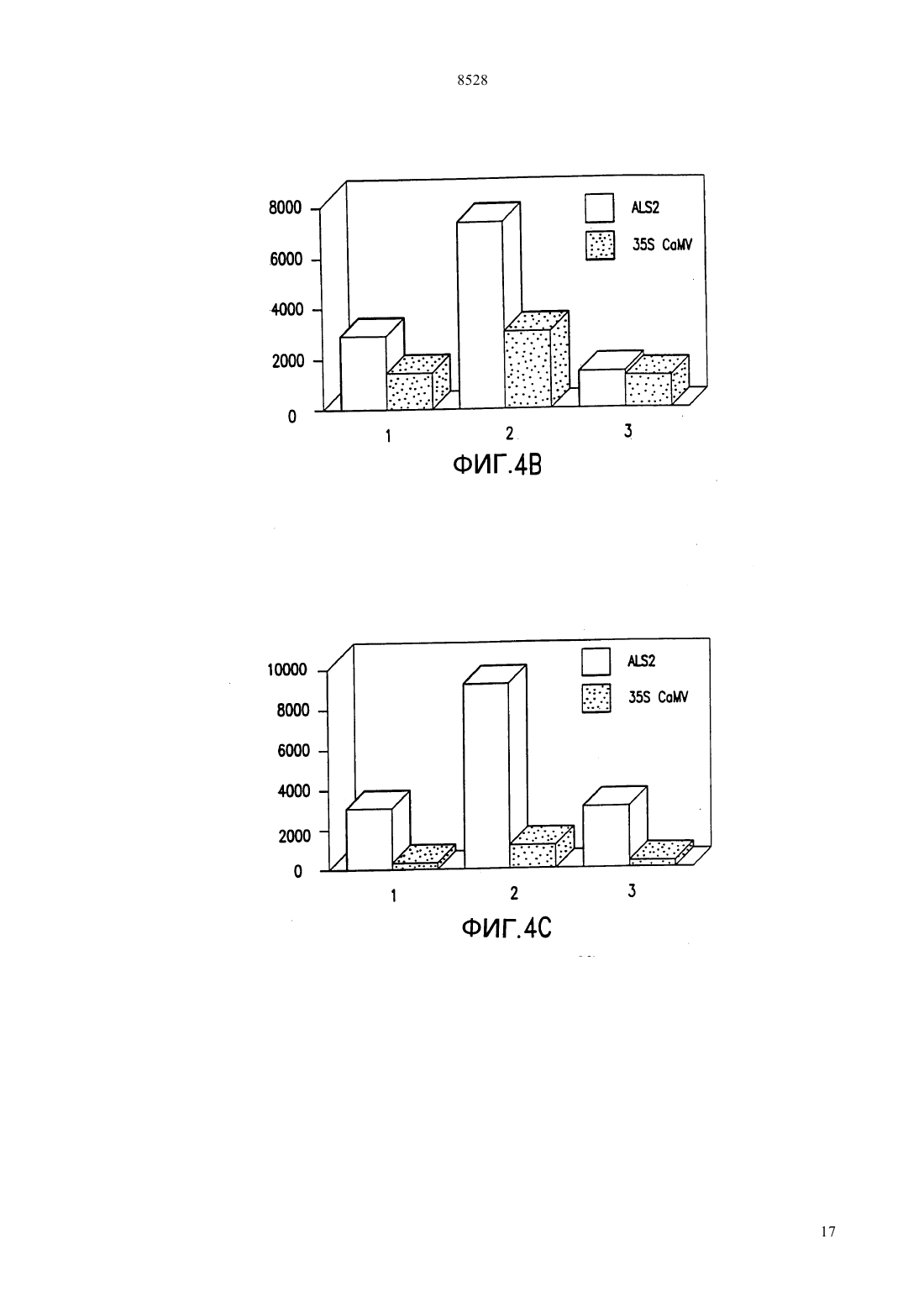
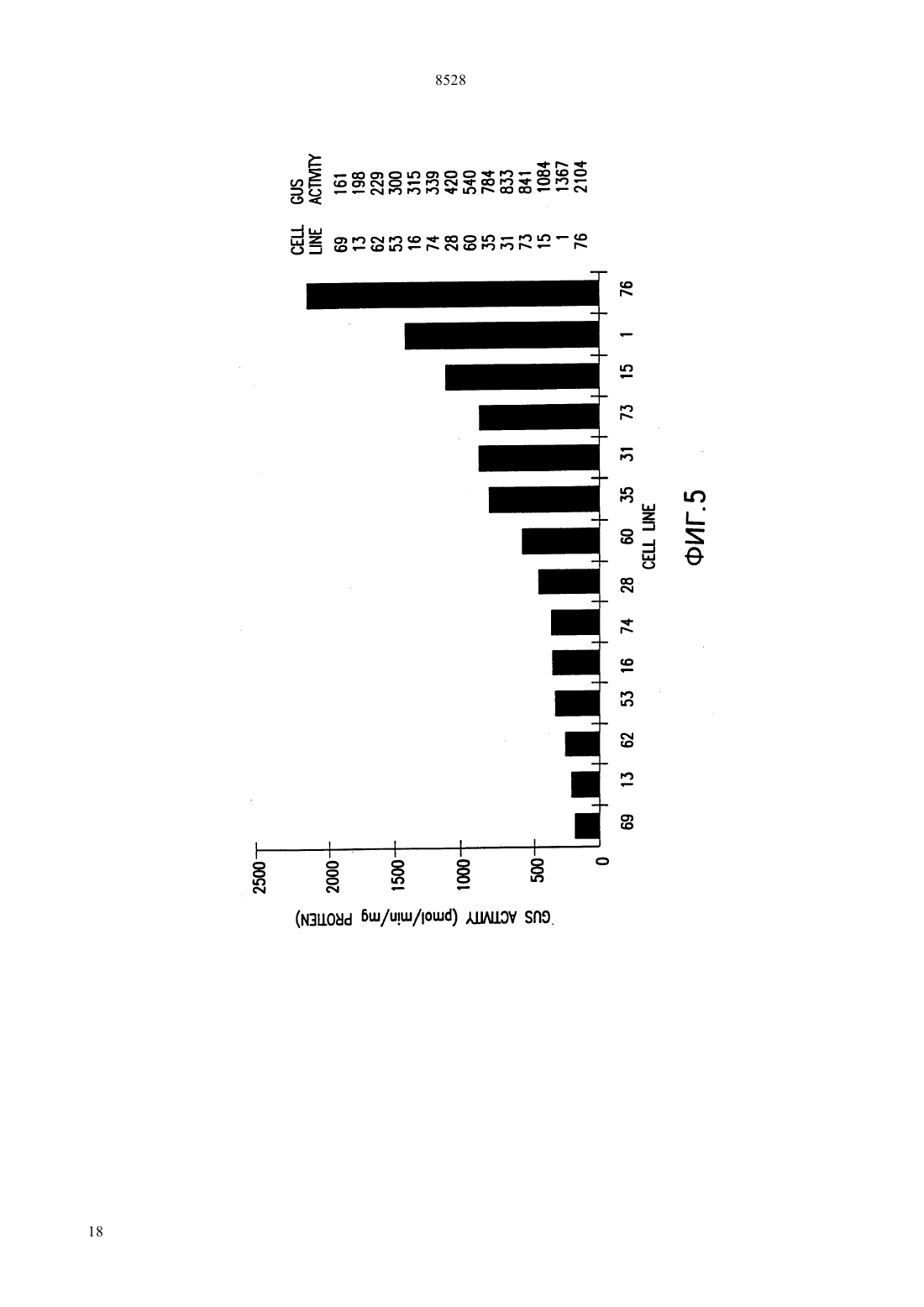
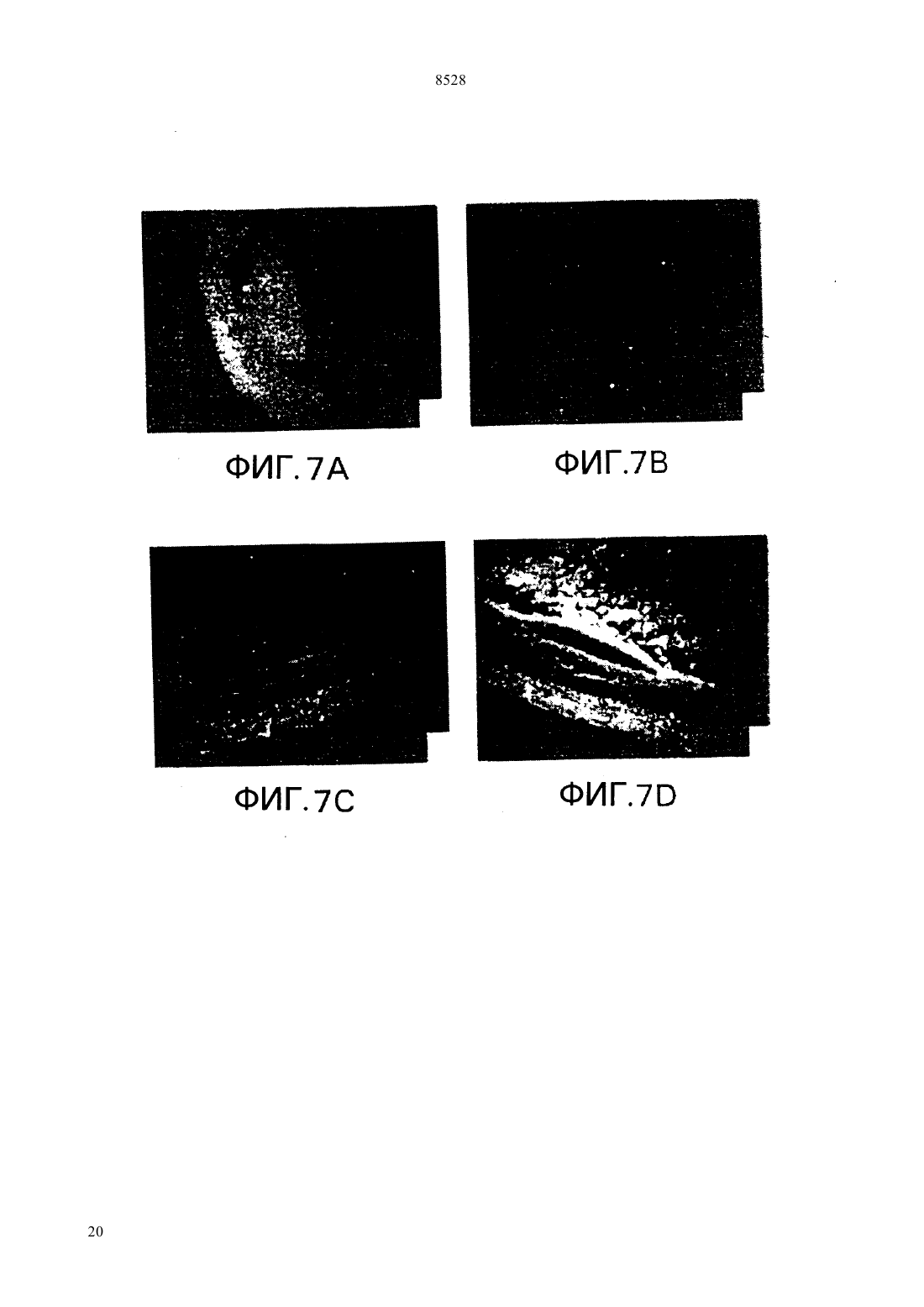
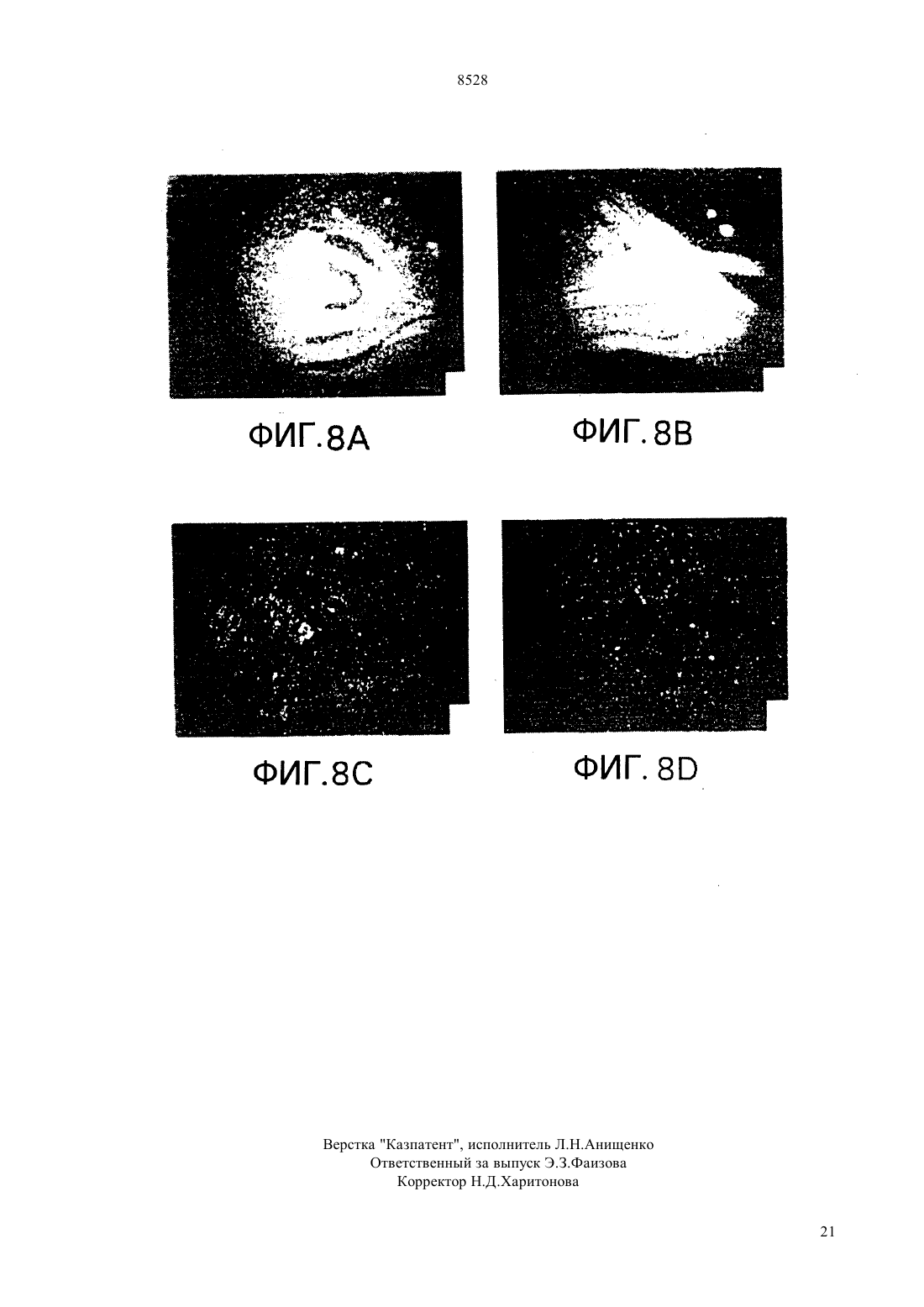
(51)61215/82, 15/60, 5/10015/10 НАЦИОНАЛЬНОЕ ПАТЕНТНОЕ ВЕДОМСТВО РЕСПУБЛИКИ КАЗАХСТАН(54) ИЗОЛИРОВАННАЯ НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, ВЕКТОР, РАСТИТЕЛЬНАЯ КЛЕТКА, ЗРЕЛОЕ РАСТЕНИЕ,СПОСОБ ВЫСОКОУРОВНЕВОГО ЭКСПРЕССИРОВАНИЯ ГЕТЕРОЛОГИЧНОГО ГЕНА В РАСТЕНИИ И РАЗЛИЧНЫХ ЕГО ТКАНЯХ,КОНСТРУКЦИЯ НУКЛЕИНОВОЙ КИСЛОТЫ,СПОСОБ ИСПОЛЬЗОВАНИЯ КОНСТРУК ЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ ВЫБИРАЕМОГО МАРКЕРА(57) Настоящее изобретение относится к изолированным некодирующим нуклеотидным последовательностям, полезным в качестве промоторов для экспрессии гетерологичных генов у растений. Настоящее изобретение также относится к векторам и клеткам растений, включающим изолированные нуклеотидные последовательности. Для экспрессии интродуцированных генов на высоком уровне и в различных тканях растений используютсяпромоторы из кукурузы. Были клонированы и секвенированы промоторы изи 2 генов кукурузы, и регионы промоторов этих генов затем введены в плазмиду 5 к гену-репортеру -глюкуронидазы. Оба фрагмента промотора происходят из линии кукурузы 12. Фрагмент промоторадлиной приблизительно 1400 пар оснований, в то время как промотор 2 содержит 819 пар оснований. Настоящее изобретение относится к изолированным некодирующим нуклеотидным последова 8528 тельностям, используемым в качестве промоторов превосходила таковую с геном-промотором алкодля экспрессии гетерологичных генов у растений. гольдегидрогеназы 1 кукурузыи зависела от Настоящее изобретение также относится к векторам присутствия интактного интрона . и клеткам растений, включающим эти изолировани др. (1991) отмечали, что оптиные нуклеотидные последовательности. мизированные векторы для трансформации одноЦарство растений подразделяется на два типа дольных были сконструированы при использовании моховидныеи сосудистые растения либо промотора 35 вируса мозаичности цветной. Типвключает свыше капусты // , либо 266 000 видов, сгруппированных в четыре подтипа. промотора . Испытания временной экспрессии Подтипвключает класс покрытосеменные были выполнены на трансформированных прото. Этот класс делится на два подкласса пластах как риса, так и кукурузы. Добавление индвудольные и однодольные. тронаи оптимизированного сайта инициализаПоскольку однодольные включают многие важ- ции трансляциик любой промоторной посленые пищевые и фуражные культуры, генетики рас- довательности значительно увеличивало генную тений остро заинтересованы в том, чтобы иметь экспрессию. к же, как неопубликованный резульвозможность создавать трансгенные однодольные. тат, отмечалось, что промотор актина обнаруживает Известно около 50000 видов однодольных. Они способность к управлению экспрессиейв кратвключают лилии, пальмы, орхидеи, ирисы, тюльпа- ковременных испытаниях на протопластах пшенины, осоки и злаки. Злаки включают кукурузу, пше- цы, овса, ячменя и сорго. ницу, рис и все прочие злаковые зерновые. К сожаи др. (1991) отмечали, что ислению, однодольные чрезвычайно тяжело поддаются следования по гибридизациирастений трансгенноинженерным манипуляциям, так что большин- генного риса, выполненные с - слиянием,ство работ с растениями проводится с двудольными. показали, что промоторимеет базовый тип эксДвудольные больше по числу видов из этих прессии как в вегетативной, так и репродуктивной двух групп, приблизительно известно 200000 их ви- ткани. дов. Лютик, львиный зев, гвоздика, магнолия, мак,и др. (1992) отмечали, что растения капуста, роза, горох, пуансеттия 1, хлопчатник, как- трансгенного риса были отобраны на устойчивость к тус, морковь, черника, мята, томат, подсолнечник, биалофосу после трансформации -гена, экспресвяз, дуб и клен представляют 19 из 250 семейств сируемого под контролем либо 35 промотодвудольных. ра, либо промоторариса. Генетическая информация, заключенная в мо .и др. (1992) отмечали, что лекуле ДНК, обычно служит матрицей для синтеза протопласты кукурузы, трансформированные слиябольшого количества более коротких молекул РНК, нием гена -1- кукурузы, в испытаниях вребольшинство которых в свою очередь служат мат- менной экспрессии обнаружили приблизительно рицами для синтеза специфических цепей полипеп- 10-кратно повышенные уровниактивности, по тидов. Особые сегменты нуклеотидов, называемые сравнению с клетками кукурузы трансформированчасто промоторами, распознаются молекулами РНКными путем слияния гена -35-, Нозернполимеразы как сигнал к синтезу РНК. По оконча- блот анализ уровней -1 и -1 транскриптов,нии транскрипции функциональной цепи РНК вто- проводимый вслед за тепловым шоком сеянцев курой класс сигналов приводит к прекращению синте- курузы, продемонстрировал, что оба гена достаточно за РНК и к отделению молекул РНК-полимеразы от хорошо экспрессируются при 25 С, но индуцируютсоответствующих им матриц ДНК. ся вслед за тепловым шоком. В настоящее время имеется ряд общих промои др. (1992) отмечали, что стабильторов, которые используются для управления экс- но трансформированные трансгенные растения риса прессией гетерологичных генов у однодольных рас- были получены после электропоратически опосредотений. ванной трансформации -гена, экспрессируемогои др. (1990) отмечали, что испы- под контролем промотора -1 кукурузы и селектания временной экспрессии в конструкции, где ции на биалофос. Этот результат демонстрирует, что промотор гена актина 1 риса (1) был присоеди- промотор -1 может быть использован для доснен к бактериальному гену -глюкуронидазытаточно эффективного управления высокими уровв трансформированных протопластах риса, показа- нями генной экспрессии у риса, позволяя проводить селекцию и регенерацию фертильных трансгенных ли, что промотор актина управляет высокими уровнями генной экспрессии. Эта экспрессия 6-кратно растений риса..и др. (1993) отмечали, что стабильно 1 трансформированные растения пшеницы были поМолочный красивейший,- декоративный кустарник, произрастающий в лучены после бомбардировки каллусов, выращентропических лесах Мексики. Очень популярен в озе- ных из незрелых эмбрионов как с -геном, так и с, каждый при этом экспрессировался под конленении на юге США. тролем промотора -1 кукурузы, за этим следовала селекция на биалофос. Этот результат демонст 2 8528 рирует, что промотор -1 может быть использован тов, демонстрируя, что этот промотор может быть для достаточно эффективного управления высокими использован для управления экспрессией выбираеуровнями генной экспрессии у пшеницы, позволяя мых маркерных генов при получении трансформипроводить селекцию и регенерацию фертильных рованных злаков. трансгенных растений. Обзор промоторных элементов, используемыхи.(1994) отме- для контроля экспрессии чужеродного гена у трансчали, что стабильно трансформированные фертиль- генных злаков, был недавно опубликован, и здесь ные растения ячменя были получены после микро- мы на него ссылаемся (, 1994). проекционной бомбардировки двумя генами Ряд промоторов в настоящее время используетгеном и , тканей эмбрионов ячменя под контро- ся для трансформации двудольных растений. Эти лем промотора -1 кукурузы, за которой следовала промоторы происходят из различных источников. селекция на биалофос. Этот результат демонстриру- Одна группа широко используемых промоторов быет что промотор -1 может быть использован для ла выделена из, где их достаточно эффективного управления высокими функция состоит в управлении экспрессией генов уровнями генной экспрессии у ячменя, позволяя опин-синтазы, переносящих сегмент Т-ДНК, котопроводить селекцию и регенерацию фертильных рый интегрируется в геном растения во время интрансгенных растений. Эксперимент, включающий фекции. Эти промоторы включают промотор октобомбардировку небольшого количества растений пин-синтазы(.., 1985 .либо с -полосой, либо с 35-полосой, по-., 1985), промотор маннопин-синтазыказал, что нет существенного различия в получен- (.., 1985 . .ном количестве трансформантов.. . , 1990) и промотор нопалини др. (1991) отмечали, что синтазы(. .., 1983 слияние промотор 1 кукурузы -было вве-., 1983 . .., 1983 .дено в протопласты риса с целью получения транс-., 1984 .., 1985). Эти промотогенных растений риса. Активностьу трансген- ры активны в разнообразных растительных тканях. ных растений определяли для выяснения способа Для управления экспрессией гетерологичных экспрессии . Было обнаружено, что промотор генов двудольных используется также несколькокукурузы способен промотировать базовую вирусных промоторов (. .. М. экспрессию во всех частях исследованных растений. , 1986). Промотор 35 вируса мозаичности Как было предварительно продемонстрировано для цветной капусты - один из промоторов, которые чаэкспрессииу кукурузы, управляемаяэкс- ще других используются для трансформации двупрессияиндуцировалась в корнях в анаэробных дольных, потому что он дает высокие уровни генной условиях. экспрессии почти во всех тканях (..,. .и др. (1991) отмечали, что промотор 1985 . .., 1985 . .., 1986 кукурузы был модифицирован добавлением . .., 1986). Используются также и момультиплетных копий анаэробного элемента гена дификации этого промотора, включая конфигура кукурузы и элементовгена октопин синта- цию с двумя тандемными 35 промоторами (.зы. В тестах по., 1987) и -35 промотор (..,временной экспрессии в протопластах различных 1990), который состоит из промотора маннопинвидов однодольных, трансформированных - синтазы в тандеме с 35 промотором. Оба эти про, он был лучшим составляющим, дающим 10- мотора управляют даже более высокими уровнями 15-кратное увеличение уровней экспрессии по срав- генной экспрессии по сравнению с единичной копинению с промотором 35 у пшеницы, кукуру- ей 35 промотора. Другие вирусные промоторы,зы, риса, пшеницы-однозернянки- которые использовались, включают промотор 19 и плевела многоцветкового. вируса мозаичности цветной капусты (.. и.(1992) отмечали,., 1984 .., 1985) и 34 промотор что стабильные трансформанты были получены при вируса мозаичности норичника трансформации эмбриогенного каллуса сахарного (.., 1990) тростника геном неомицин фосфотрансферазы под Изучение экспрессии(интаза ацетоконтролемпромотора. оксикислот) у ряда растений показывает, что. .и др. (1994) отмечали, что экспрессируется во всех растительных тканях.промоториспользовался для управления экс-и.(1990) отмечали, что энзипрессией четырех различных выбираемых маркер- матические тесты, выполненные на различных тканых генов (неомицин фосфотрансферазы, гидроми- нях лимской фасоли, продемонстцин фосфотрансферазы, фофинотриицин -ацетил- рировали, что активностьпроявлялась во трансферазы и мутантной ацетолактатсинтазы, всех тестируемых тканях, включая листья, стебли,дающей сопротивляемость гербицидам), которые корни, цветки, стручки и меристемы. Активность были трансформированы как в пшеницу, так и в рис.обнаруживалась фактически постоянной в Каллус пшеницы и трансформированные растения стеблях, но уменьшалась в листьях, корнях и меририса были получены после селекции трансформан- стемах с увеличением возраста тканей. 3 8528.и др. (1993) отмечали, что та- прессия химерных плазмид в клетках кукурузы опбак содержит два гена, кодирующие синтазу ацето- ределялась путем анализа ферментативной активнооксикислот,и . По-видимому, оба гена сти . Активность промотора 2 была равной экспрессируются во всех типах тканей с приблизи- или превосходила активность промотора 35 тельно 4-кратным варьированием уровня экспрессии в обоих типах клеток (фиг. 4). Фиг. 5 показывает рев различных тканях. Развивающиеся органы имеют зультаты -глюкуронидазных тестов, выполненных наивысшие уровни экспрессии. Исследования гиб- на клеточных линияхкукурузы, стабильно ридизациипродемонстрировали, что наивыс- трансформированных либо 221 (2-шие уровни экспрессии наблюдались в метаболиче-терминаторная плазмида), либо рАС 400 ( ски активных или интенсивно делящихся клетках. 35 терминаторная плазмида). Анализ расУровни экспрессиибыли выше, чем у пределениямРНК путем гибридизациидля всех исследованных тканей. радиоактивно меченных РНК-зондов в растительнуюи др. (1992) отмечали, что виды ткань показывает, что промоторыкукурузысодержат мультигенные семейства, коди- активны в большинстве частей растения (фиг. 6,рующую синтазу ацето -оксикислот. Вфиг. 7, фиг. 8). были идентифицированы четыре из пяти генов Активность промотораанализировалась. Тесты с РНКазной защитой с использовани- у растений арабидопсиса , которые были ем геноспецифических зондов проводились для оп- стабильно трансформированы с использованием ределения типов экспрессии различных членов се-. Входной промоторный мейства генов у различных видов . Обнару- фрагмент генаарабидопсиса присоединяли к жено, что два из этих генов, 1 и 3 хо- гену-репортеру , вставленному в бинарный рошо экспрессируются во всех исследованных тка- вектор 9 и далее использовали для трансфорнях. Транскрипты 2 обнаруживались только в мации арабидопсиса. Анализы трансформированных репродуктивных органах и экстра-эмбриональной растений показывают, что при этом происходит эксткани семян. Транскрипты, кодируемые четвертым прессия(судя по активности промотора) в геном, 4, не были обнаружены, и поэтому большинстве частей растения. предположили, что он представляет собой псевдоФиг. 1 раскрывает последовательностьпроген. моторакукурузы ХА 17..и .(1991) Фиг. 2 раскрывает последовательность 2 отмечали, что сравнение активностив моло- промоторакукурузы ХА 17. дых листьях и клетках кукурузы , выращиваеФиг. 3 раскрывает последовательность 2 мых в суспензионной культуре, показало, что актив- промоторакукурузы 12. ность клетокна грамм сырого веса была приФиг. 4 является столбчатой диаграммой, предблизительно в 5-8 раз выше по сравнению с образ- ставляющей-глюкуронидазную активность во цами листьев. Поскольку клеткиявляются аквременных тестах на протопластах клеток кукурузы тивно делящимися, этот результат согласуется с реили клетках риса в суспензизультатами предыдущих исследований табака и онной культуре после трансформации 221 лимской фасоли, которые проде(2-промотор терминаторная плазмида) монстрировали, что более молодые активно деляили рАС 400 ( 35 терминаторная щиеся ткани обладают большей активностьюплазмида). Активностьрассчитывали как по сравнению со старыми. пмоль/мин/мг протеина. Представлены результаты Промоторыиз кукурузы используются трех независимых экспериментов. для экспрессии интродуцированных генов на высоФиг. 5 является столбчатой диаграммой, предком уровне и в различных тканях растений. ставляющей -глюкуронидазную активность в стаПромоторы из генови 2 клонируются и секвенируются (фиг. 1, фиг. 2, фиг. 3), и промотор- бильно трансформированных клеточных линиях ные фрагменты из этих генов затем интродуцируют- кукурузыпосле трансформации 221 (2-промотор терминатор) ся в плазмиду 5 к гену-репортеру -глюкуронидазы или рАС 400 ( 35 терминатор). СК. Оба промоторных фрагмента происходят от обозначает нетрансформированную контрольную линии кукурузы 12. Промоторный фрагментткань. Активностьрассчитывалась в приблизительно длиной 1400 пар оснований, в то пмоль/мин/мг протеина. время как промоторный фрагмент 2 содержит 819 Фиг. 6 - исследования по гибридизациив пар оснований. Чтобы определить активность пролистовой мутовке двухнедельных сеянцев кукурузы моторов , для анализа уровней кратковременс использованием радиоактивно помеченных РНКной экспрессии химерные плазмиды были затем зондов. Срезы тканей были препарированы и гибриперенесены в протопласты кукурузыдизированы с РНК-зондами, кодирующими либо/черная мексиканская сладкая/ и протопластысенсорную полосу 25 (-), либориса. Для сравнения протопласты были также антисенсорную полосу . Для сравнения, в трансформированы плазмидой с промоторомкачестве зондов использовались(малая субъе 35, управляющим геном-репортером . Эксдиница ) сенсорная полоса (-) или 4 8528 антисенсорная полоса . В каждом случае просо. Работающий в данной области также должен ожидалось, что только антисенсорная полосазнать, что заявляемые промоторы будут также будет вступать в гибридизацию с мРНК, присутст- управлять экспрессией у двудольных, хотя экспресвующей в ткани, А) зонд ) -зонд сия промоторов однодольных у двудольных, по) зонд ) -зонд. видимому, характеризуется более низкими уровняФиг. 7 - исследования по гибридизациив ми, по сравнению с ее протеканием у однодольных. сердцевине зародыша кукурузы спустя 12 суток поРаботающий в данной области должен знать,сле опыления. Образцы подготовлены так же, как и что промотор 2 кукурузы можно использовать для на фиг. 6. ) эмбрион и суспензорий, зонд управления генной экспрессией у других видов од) эмбрион и суспензорий, -зонд нодольных. Например, промотор 1 риса управля) перикарп, алейроновый слой и эндосперм, ет генной экспрессией в протопластах кукурузы,-зонд промоторкукурузы использовался для селекции) перикарп, алейроновый слой и эндосперм, трансгенных пшеницы, ячменя и риса, а промотор зонд.арабидопсиса, промотор двудольного, исФиг. 8 - исследования по гибридизациив пользовали для управления экспрессией генаапикальной меристеме молодых растений кукурузы. у трансгенных табака и картофеля. Упомянутый 2 Образцы подготовлены так же, как и на фиг. 6. ) и кукурузы лучше всего функционирует в кукурузе, но) зонд ) и ) -зонд. также управляет экспрессией генов у другого одноУченые исследуют способы применения гене- дольного. На основе исследований, выполненных на тической модификации для придания растениям кукурузе и других видах, следует заключить, что желательных свойств. Методики генной инженерии, этот промотор будет управлять базовой экспрессией используемые для улучшения характеристик, таких гена у растения везде. Наиболее высокие уровни как вкус, структура, размер, устойчивость к вредите- экспрессии наблюдаются либо в активно делящихся,лям и сопротивление воздействию гербицидов, цвет, либо в метаболически активных тканях. кислотность или сахаристость растений, употребДля трансформации однодольных культур исляемых в пищу, развиваются как более быстрая пользовались разнообразные методики, хорошо изстратегия, чем традиционные методы скрещивания- вестные работающим в данной области, которые,селекции. однако, не ограничиваются микропроективной бомНастоящее изобретение относится к промоторам бардировкой, ПЭГ-опосредованной трансформациАНА кукурузы и арабидопсиса, к векторам и к ей, электропорацией и силиконовыми волокнами. растительным клеткам, включающим эти промото- Все эти методики включают использование векторов ры. Применительно к данной заявке промотор опре- ДНК для доставки нуклеотидных последовательноделяется как нуклеотидная последовательность, на- стей, подлежащих трансформации. Векторы, приходящаяся в начале гена, которая действует как годные для использования в настоящем изобретесигнал для связывания с РНК-полимеразой. Гены нии, включают, но не ограничиваются ими, векто и 2 кукурузы клонируются и секвенируются, и ры, переносящие маркерные гены, используемые для промоторные участки из этих генов затем интроду- селекции трансгенного материала, включая гены,цируются в плазмиду 5 к гену-репортеру . При- придающие устойчивость к гигромицину, канамицименительно к данной заявке ген-репортер определя- ну, биалофосу и гербицидам, производным имидается как нуклеотидная последовательность, которая золинона и сульфонил-мочевины. присоединена в конец интересующего промотора,Следующий пример служит только для иллюсттак что транскрипты, инициализирующиеся с этим рации данного изобретения и не может быть истолпромотором, затрагивают ген-репортер. Гены- кован как любым образом ограничивающий это изорепортеры обычно кодируют ряд легко определяе- бретение. мых по своей активности ферментов, например, в ПРИМЕР настоящем изобретении экспрессия химерных плазЭффективность промоторови 2 оценивамид в клетках кукурузы определяется анализом ак- ется путем измерения активностив протоплативности фермента глюкуронидазы . стах кукурузы и риса или клеточных линиях кукуруРаботающий в данной области должен знать, зы с конструкциями, в которых эти последовательчто промоторыобладают высокой активно- ности промотора присоединены к гену . Пригостью во многих растительных тканях различного товление векторов и протокол трансформации опипроисхождения, и их можно использовать для экс- саны ниже. прессии новых генов у разнообразных растений. Конструкции, содержащие химерные гены Новые гены включают, но не сводятся к ним, гены 35-, - и 2 устойчивости к гербицидам, детоксикации и сопроПлазмида рАС 400 является 19-основной тивляемости растительным патогенам. плазмидой, образованной слиянием 418 пар основаЗаявляемые промоторы могут использоваться ний фрагмента - промотора 35,для экспрессии гетерологичных генов у однодоль- клонированного у начала 1.7- фрагмента ных, включая, но не ограничиваясь такими видами, , содержащего ген , и 700 пар оснований кукурузу, рис, пшеницу, ячмень, сорго, овес, рожь и фрагмента -, содержащего терминатор 5 8528 октопин-синтазы. Геныи 2 получены путем ции как , так и А 188 хВ 73 клеток и клеток риса. скрининга библиотеки генома, приготовленной из Этот результат подтверждает идею, что промотор кукурузы линии 12. Фрагмент -, содер- 2 эффективно управляет высокими уровнями эксжащий 1400 пар оснований последовательности пе- прессии, что дает ему возможность управлять эксред кодономинициализации гена , субкло- прессией маркерного гена. нирован в рАС 4 на место 35 промотора для Гибридизацияобразования 223. Фрагмент -, содерПрепараты на предметных стеклах готовились в жащий 819 пар оснований перед кодономгена основном по . .. (1988). Ткань фик 2, был субклонирован впереди того же самого сировали в 4 формалине, 6 звоживали в этило-ос терминатора связывания ввом спирте, очищали в ксилоле и заключали в пара-для образования 221. После- финовую пленку. Из ткани готовили срезы 8-10 м довательность промотора 2 кукурузы 12 пред- и помещали на предметные стекла, покрытые полиставлена на фиг. 3.-лизином. Парафин удаляли ксилолом, и ткань поТрансформация и оценка протопластов риса и вторно регидратировали (обратная проводка) прокукурузы мыванием этанолом и ополаскиванием в воде. РНКПротопласты были выделены из клеток в сус- зонды готовили из обеих лент ( и -) 172 пензионной культуре рисаили кукурузы нуклеотидного фрагмента участка, кодирующего(, ) и трансформированы 2, и 392-нуклеотидного фрагмента участка, кодиплазмидами рАС 221 В или рАС 400 в соответствии с рующего , используя набор. протоколами ПЭГ-опосредованной трансформации Препараты на предметных стеклах подвергали гибпо . .. (1989) и . .. (1990). ридизации согласно протоколу. Во временных тестах трансформированные прото- (1988) при 50 С на ночь в разбавлении 14 пласты риса распределялись по поверхности милли- (100 л 10-кратных солей (3 М , 10 мМ поровских фильтров, помещенных поверх среды, 6.8, 50 мМ )400 л формамида 200 л содержащей фидерные клетки, и трансформированные протопластыкультивировались в 3 мл 50 сульфата декстрана 40 л 10 мг/мл тРНК жидкой среды. Спустя двое суток после трансфор- 10 л 150 л 10 мг/млА мации культуры протопластов были собраны и экст- /полиаденилат/) с зондом, денатурированном в 50 рагированы буфером для извлечения . Актив- формалине и 10 ммпри 80 С в течение ностьизмерялась флюориметрически в соот- 30 секунд. Препараты на предметных стеклах проветствии с протоколом . .(1987). мывали дважды по 15 мин в промывном буфере Для обнаружения стабильных трансформантов (однократные соли, 50 формамид, 10 мМв культуре кукурузыпротопласты были 8, 1 мМ , 10 мМ ) при 50 С, обрабатывакотрансформированы 19 (содержащей выби- ли РНКазой А (20 г/мл в ) в течение 30 мин раемый маркерный ген, кодирующий неомицин при 37 С, промывали пятикратно вбуфере при фосфотрансферазу) и 221 или рАС 400. После 37 С за 1 час, дважды промывали по 30 мин в протрансформации протопласты культивировались на мывном буфере при 50 С, обезвоживали в этаноле миллипоровских фильтрах, помещенных поверх и высушивали на воздухе. Препараты на предметсреды, содержащей фидерные клетки. Спустя неде- ных стеклах авторадиографировали путем погружелю протопласты переносили на среду, содержащую ния в эмульсию, предварительно нагретую до 37 С фидерные клетки и 100 мг/л канамицина. Культуры в темноте, высушивали в течение 30 мин-1 часа и протопластов переносили на свежую среду Мураси- хранили в темноте при 4 С до проявления. Препаге-Скуга с 100 мг/л канамицина до тех пор, пока раты проявляли в течение 2 мин, ополаскивали в резистентные каллусы не стали видимыми. Каллу- воде, фиксировали в течение по крайней мере 5 мин сы, резистентные к канамицину, собирали и выра- и снова ополаскивали в воде. Ткань окрашивали с щивали отдельно в течение двух-трех недель в при- помощью(синий краситель) и обесцвесутствии канамицина. Каллус, резистентный к кана- чивали в этаноле и ксилоле. После установки в мицину, окрашивали - или тестировалипредметный столикткань просматривали с по протоколу . .(1987) с целью скри- использованием микроскопа темного поля. нинга -позитивного каллуса. Каллус, идентифиДанные экспериментов по гибридизациицированный как экспрессирующий , измельчали на фиг. 6-8 показывают, что ген в эмбрионе кукурув экстракционном буфере и тестировали, активность зы экспрессируется везде.измеряли флюориметрически. Оказывается возможным оценить экспрессию Данные этих экспериментов представлены на промоторапутем фиг. 4 и фиг. 5. 1) конструирования гена связывания 2 -Мутантный генкукурузы, ответственный и определения структуры активностиу трансза резистентность к гербицидам группы имидазоли- генных растений кукурузы или риса. Предыдущие нона и управляемый промотором 2 кукурузы, ис- исследования с использованием промотора кукурузы пользовался в качестве выбираемого маркера для продемонстрировали пригодность оценки экспресполучения трансгенного каллуса после трансформа- сии промотора кукурузы у риса (6., 1991). После селекции трансгенных растений с ШТАТ Нью Джерси целью определения как специфичности по ткани, так(Е) СТРАНАСоединенные Штаты и по типу клеток были выполнены гистохимические ИНДЕКС 07470-8426 анализы растительных тканей на различных стадияхДАННЫЕ О КОМПЬЮТЕРЕ развития. Этот способ обычно используется для МЕДИУМ ТИП Флоппи диск оценки активности промотора как у однодольных, КОМПЬЮТЕРсовместимый так и у двудольных ОПЕРАЦИОННАЯ СИСТЕМА 2) тесты по временной экспрессии проведены на -/протопластах, полученных от различных видов рас СОФТВЕЙР Патентные документы 1.0,тений после трансформации конструкций 2 - Версия 1.25. Этот подход используется для оценки способ-СВЕДЕНИЯ О ЗАЯВКЕ ности различных промоторов функционировать у ЗАЯВКАСША гетерологичных видов. Протопласты трансформиро ДАТА ПОДАЧИ вали с помощью соответствующей конструкции и КЛАССИФИКАЦИЯ выдерживали для того, чтобы интродуцированныйИНФОРМАЦИЯ О ПОВЕРЕННОМ/АГЕНТЕ ген экспрессировался и накопился соответствующий протеин. После такой выдержки клетки тестирова Ф.И.О. ГАРИНГТОН, Джеймс Дж. лись на присутствие протеина, кодируемого трансге РЕГИСТРАЦИОННЫЙ НОМЕР Р 38,711 ном для определения эффективности управляемой-ХАРАКТЕРИСТИКА СИКВЕНСА кодирующая 5 к структуральному гену (про ДЛИНА 413 спаренных оснований мотору) для синтазы ацето-оксикислот , ис ТИП нуклеиновая кислота пользуемая для экспрессии в интродуцированных форма цепи одиночная генах растений. ТИП МОЛЕКУЛЫ ДНК (геномная) АДРЕСАНТ Америкен Цианамид Компани УЛИЦА Уан Цианамид Плаза ТИП МОЛЕКУЛЫ ДНК (геномная) ТИП МОЛЕКУЛЫ ДНК (геномная) ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Изолированная нуклеотидная последовательность, включающая промотор синтазы ацетооксикислот для экспрессии генов у растений и последовательность, кодирующую гетерологичный ген. 2. Последовательность по п.1, отличающаяся тем, что промотор синтазы ацето-оксикислот выбирают из промоторов для 1 и 2 генов кукурузы. 3. Последовательность по п.1, отличающаяся тем, что промотор синтазы ацето-оксикислот выбирают из 9(а) нуклеотидной последовательности по п.1,включающей последовательность со следующими характеристиками длина 413 спаренных оснований, тип нуклеиновая кислота, скрученность ни ти одиночная, топология линейная, тип молекулы ДНК (геномная), гипотетически нет, античувствительность нет, представлена описанием(б) нуклеотидной последовательности по п. 1, включающей последовательность со следующими характеристиками длина 509 спарен ных оснований, тип нуклеиновая кислота, скрученность нити одиночная, топология линейная,тип молекулы ДНК (геномная), представлена описанием(в) нуклеотидной последовательности по п.1,включающей последовательность со следующими характеристиками длина 829 спаренных основа ний, тип нуклеиновая кислота, скрученность нити одиночная, топология линейная, тип молекулы ДНК (геномная), представлена описанием 4. Последовательность по п.1, отличающаяся тем, что промотор сингазы ацето-оксикислот выбирают из промоторов для 2 генов кукурузы. 5. Последовательность по п. 1, отличающаяся тем, что последовательность промотора выбирают из однодольных. 6. Последовательность по п. 1, отличающаяся тем, что последовательность промотора выбирают из кукурузы. 7. Вектор трансформации, включающий нуклеотидную последовательность по п.п. 1, 2, 3, 4, 5 или 6. 8. Растительная клетка, включающая вектор по п. 7. 12 9. Зрелое растение, включающее нуклеотидную последовательность по п.п. 1, 2, 3, 4, 5 или 6 10. Способ высокоуровневого экспрессирования гетерологичного гена в растении и в различных его тканях, включающий экспрессирование гетерологичного гена в растении под контролем нуклеотидной последовательности по п.п. 1, 2, 3,4, 5 или 6. 11. Конструкция нуклеиновой кислоты,включающая последовательность по п.п. 1, 2, 3, 4,5 или 6. 12. Конструкция нуклеиновой кислоты по п. 11, отличающаяся тем, что нуклеотидная последовательность включена в гетерологичный ген,который является мутантным геном, способным 8528 вызывать резистентность к селектированному трансгенному материалу. 13. Конструкция нуклеиновой кислоты по п. 12, отличающаяся тем, что нуклеотидная последовательность включена в гетерологичный ген,который является геном сингазы ацетооксикислот. 14. Способ использования конструкции нуклеиновой кислоты в качестве выбираемого маркера, отличающийся тем, что конструкция нуклеиновой кислоты является конструкцией по п. 12,при этом способ включает этапы рекомбинантное трансформирование растительного материала путем вставки конструкции нуклеиновой кислоты помещение растительного материала на питательную среду, включающую соединение идентификация растительного материала,способного расти в присутствии соединения. 15. Способ по п.14, отличающийся тем, что мутантный ген является геном синтазы ацетооксикислот. 16. Способ по п.13, отличающийся тем, что соединение относится к имидазолинонам или сульфонил-мочевинам. Верстка Казпатент, исполнитель Л.Н.Анищенко Ответственный за выпуск Э.З.Фаизова Корректор Н.Д.Харитонова 21
МПК / Метки
МПК: A01H 5/00, C12N 15/65, C12N 15/82, C12N 5/10, C12N 15/11
Метки: выбираемого, гетерологичного, экспрессирования, зрелое, конструкция, растение, клетка, способ, различных, конструкции, нуклеиновой, тканях, нуклеотидная, качестве, маркера, использования, высокоуровневого, вектор, растении, последовательность, изолированная, гена, растительная, кислоты
Код ссылки
<a href="https://kz.patents.su/21-8528-izolirovannaya-nukleotidnaya-posledovatelnost-vektor-rastitelnaya-kletka-zreloe-rastenie-sposob-vysokourovnevogo-ekspressirovaniya-geterologichnogo-gena-v-rastenii-i-razlichnyh-ego.html" rel="bookmark" title="База патентов Казахстана">Изолированная нуклеотидная последовательность, вектор, растительная клетка, зрелое растение, способ высокоуровневого экспрессирования гетерологичного гена в растении и различных его тканях, конструкция нуклеиновой кислоты, способ использования конструкции нуклеиновой кислоты в качестве выбираемого маркера</a>
Предыдущий патент: Ассоциированная вакцина против кампилобактериоза, сальмонеллеза и хламидиоза овец
Следующий патент: Способ восстановления и плавки металлосодержащего соединения и устройство для его осуществления
Случайный патент: Способ приготовления культуры лейкоцитов для препаратов хромосом верблюдов