Калибровка электрохимического датчика
Текст
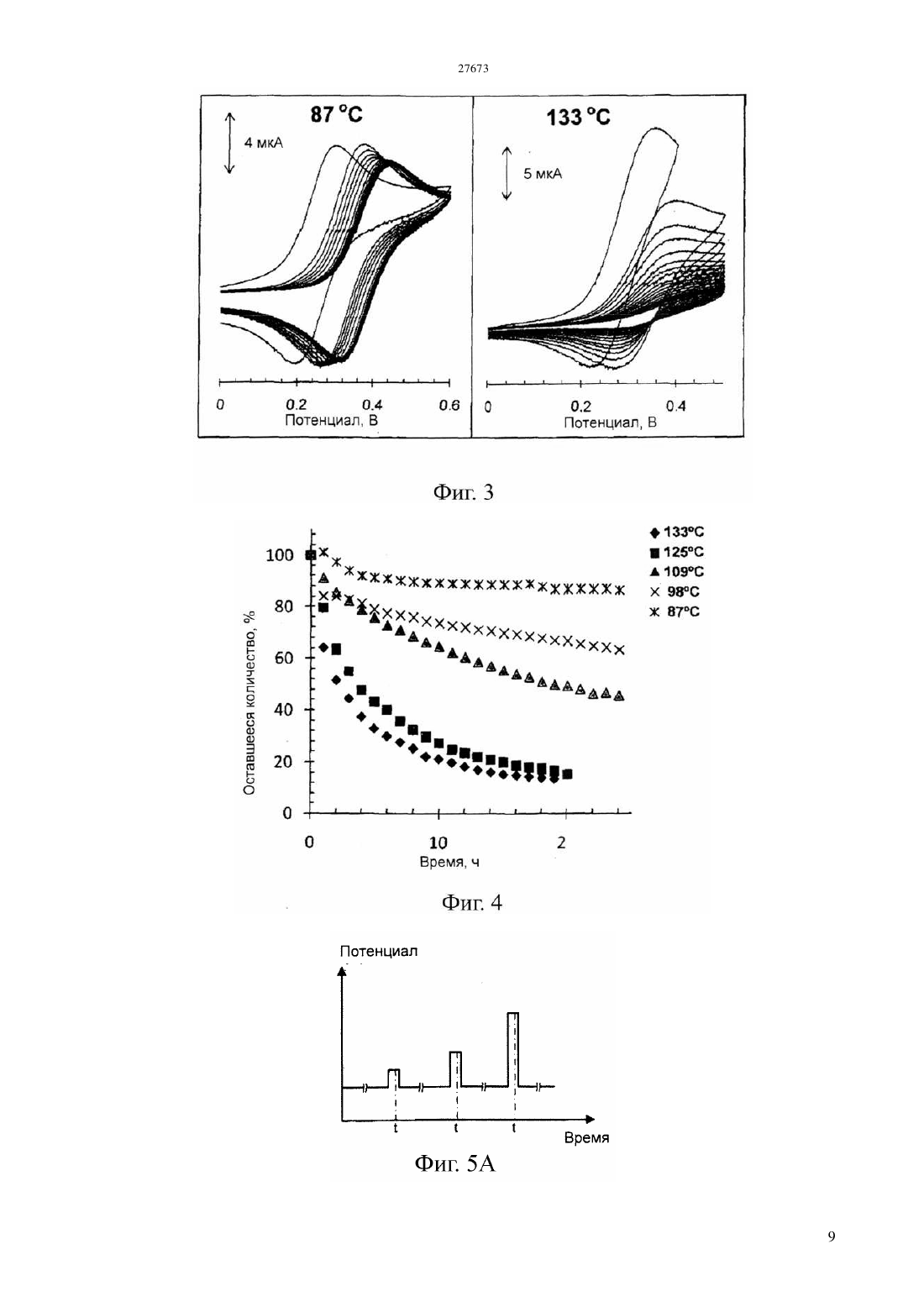
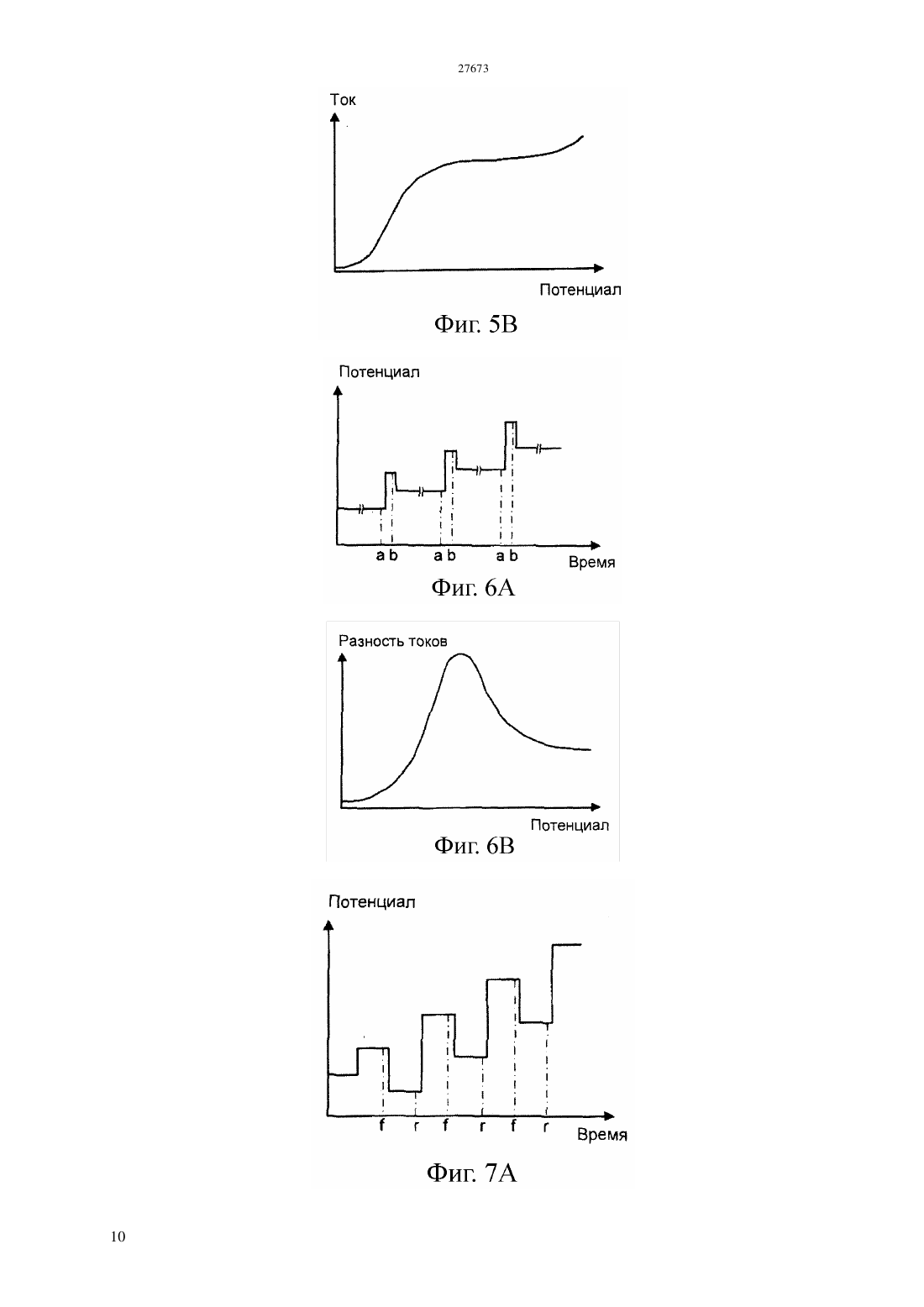
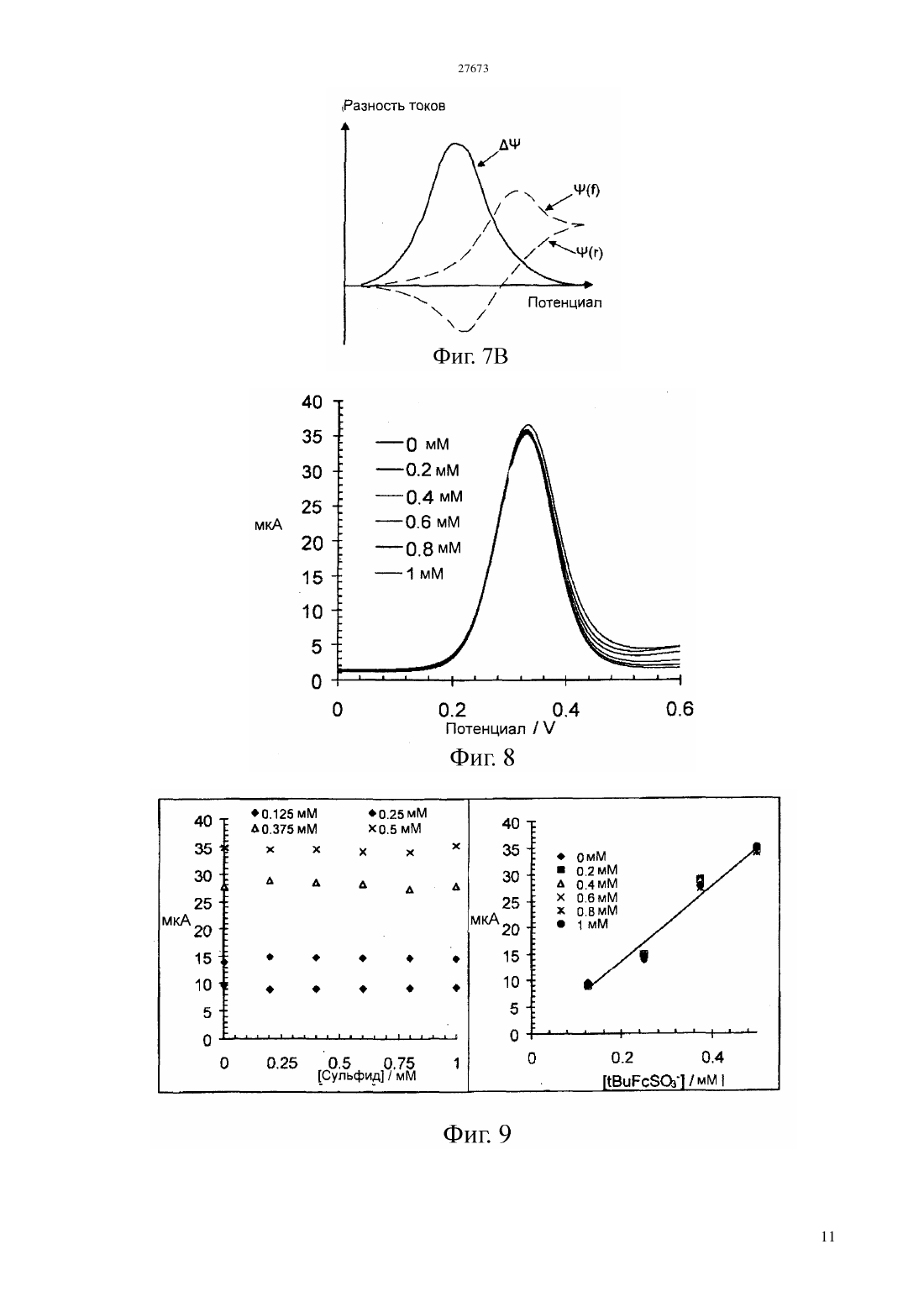
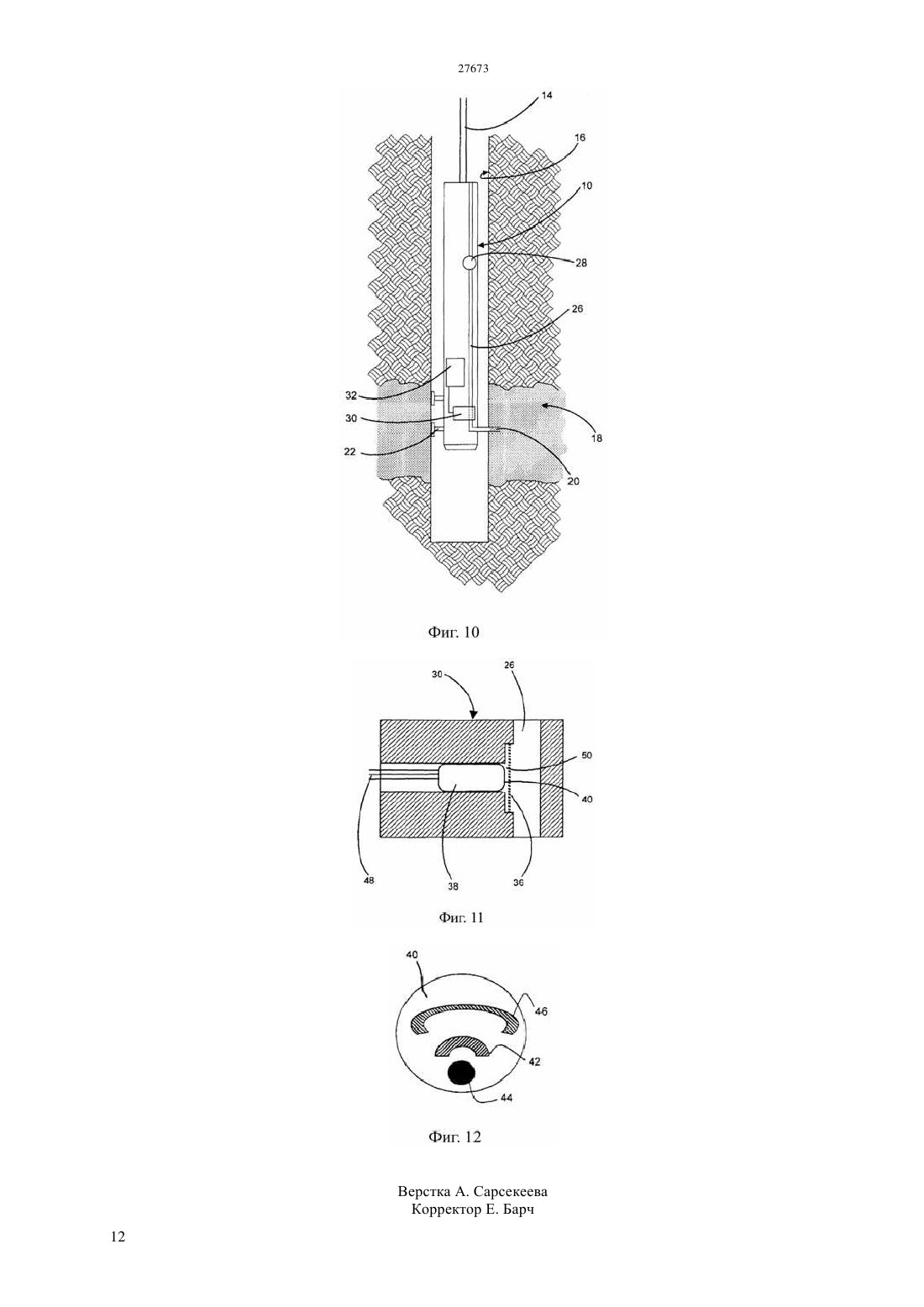
(51) 01 27/26 (2006.01) 01 33/18 (2006.01) 01 3/18 (2006.01) 21 47/00 (2006.01) КОМИТЕТ ПО ПРАВАМ ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ МИНИСТЕРСТВА ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ электродам, причем это соединение способно также претерпевать часть этого цикла путем химической реакции с аналитом. Как уже известно, этот датчик используют по способу, в котором датчик и флюид приводят в контакт, достаточно длительный, чтобы аналит мог химически реагировать с медиатором, и проводят вольтамперометрическую процедуру,подавая потенциал на электроды и наблюдая за протекающим током в течение времени,достаточного для реакции между соединениеммедиатором и аналитом, чтобы тем самым обнаружить концентрацию аналита. Отличительным признаком этого изобретения является стадия калибровки датчика путем подачи быстро меняющегося потенциала на электроды и наблюдения за протекающим током, причем изменение этого потенциала и наблюдение за током являются достаточно быстрыми, чтобы обеспечить и наблюдать электрохимическое окисление и восстановление медиатора,происходящее независимо от концентрации аналита, тем самым обнаруживая концентрацию соединения- медиатора. Быстрое изменение потенциала можно обеспечивать в режиме импульсной вольтамперометрии или квадратно-волновой вольтамперометрии.(74) Русакова Нина Васильевна Жукова Галина Алексеевна Ляджин Владимир Алексеевич(57) Это изобретение относится к электрохимическим методам анализа флюида на аналит. В нем используется датчик, содержащий электроды и соединение-медиатор, способное претерпевать цикл окисления и восстановления в ответ на изменение потенциала, приложенного к Это изобретение относится к электрохимическому анализу текучих сред(флюидов). Его можно использовать для текучих сред, встречающихся во многих местах, в частности,оно может найти особую применимость в связи с электрохимическим определением сероводорода и растворенных сульфид-анионов в местах,расположенных под землей. Уровень техники Анализ проб флюида из углеводородных скважин является важным этапом при оценке продуктивности и экономической ценности запасов углеводородного сырья. Важным фактором при определении экономической ценности запасов газообразного и жидкого углеводородного сырья является его химический состав, в частности,концентрация газообразных компонентов, таких как сероводород,двуокись углерода и метан. Следовательно, определение содержания газов в реальном масштабе времени является важным процессом при анализе скважинного флюида. Присутствие сульфидных частиц, главным образом сероводорода (2), но возможно встречающихся также в виде растворенных сульфид-анионов, оказывает значительное влияние на экономическую ценность добываемых углеводородов и на стоимость работ по их добыче. Обычно содержание серы в сырой нефти составляет в диапазоне 0,3-0,8 масс., а содержание 2 в природном газе составляет в диапазоне 0,01-0,4 масс., хотя сообщалось о концентрациях 2 в природном газе до 30 масс Желательно, чтобы можно было определять концентрацию сульфидных частиц во флюидах в самой скважине, а не отбирать пробу в скважине и не подавать ее на поверхность для проведения лабораторного анализа. Один мотив для проведения измерений в самой скважине заключается в том,чтобы избежать какого-либо воздействия изменений температуры и давления во время подачи пробы на поверхность и не бояться того, что состав,полученный при анализе на поверхности, не будет соответствовать составу в самой скважине. Еще один мотив для проведения измерения в самой скважине заключается в том, чтобы устранить задержку по времени между отбором пробы в скважине и получением результатов лабораторного анализа на поверхности земли. Однако повышенные температура и давление внутри скважины,возможно сопровождаемые наличием коррозионноактивных материалов, создают тяжелые условия эксплуатации для аналитического датчика. Был сделан ряд предложений по определению сульфидных частиц электрохимическими методами. Эти предложения включали те, в которых электрохимия задействована через взаимодействие соединения-медиатора с сульфидом, который является подлежащим определению аналитом. Это соединение-медиатор находится в электрохимической ячейке,подвергаемой воздействию сульфида. При подаче на электроды соответствующего электрического потенциала электрохимическое окисление и восстановление 2 соединения-медиатора может происходить как в присутствии, так и в отсутствии аналита - сульфида. Однако одна из окислительно-восстановительных реакций соединения-медиатора может быть также вызвана химической реакцией с сульфидом, и когда эта химическая реакция протекает, наблюдается измеримое изменение электрохимии. В качестве соединения-медиатора предлагали использовать целый ряд соединений, в том числе ферроцианидион и производные фенилендиамина. Совсем недавно использовали ферроценовые соединения. В присутствии сульфида окисленная форма ферроценового соединения или другой медиатор может подвергаться восстановлению в результате гомогенной химической реакции с сульфидом, а не путем электрохимического восстановления. Вследствие этого, присутствие аналита - сульфида приводит к увеличению наблюдаемого окислительного тока и к уменьшению наблюдаемого восстановительного тока при протекании электрохимических реакций. Величина этих изменений зависит от концентрации сульфида,который является аналитом, и это можно использовать для определения концентрации аналита. Такой подход к электрохимическому определению сульфида был описан в заявках 2001/063094 и 2004/011929. Впоследствии в, 2006, . 18, . 1658-1663 и в, 2006, . 52, . 499-450 в качестве соединений-медиаторов были предложены карбоксилат и сульфонат ферроцена. В, 2007, . 692, . 51735182 был описан целый ряд сульфонатов ферроцена,пригодных для использования по этому назначению. Однако экспериментальные исследования в этой области обычно ограничивались лабораторными экспериментами при комнатной температуре окружающей среды. Определение сульфида в скважине подобным электрохимическим способом означает воздействие на датчик и соединение, действующее в качестве медиатора,агрессивной среды подземной температуры и флюида. Придется признать, что этот датчик будет иметь ограниченный срок службы,возможно, не более суток. Величина аналитического сигнала, генерируемого при протекании реакции между аналитом и соединением-медиатором,зависит от концентрации соединения-медиатора, а также от концентрации аналита. Однако при рабочих температурах, с которыми, вероятно,придется сталкиваться, соединение-медиатор может претерпевать значительное разложение на протяжении ограниченного срока службы электрохимического датчика, находящегося в скважине. Один способ устранить этот недостаток состоит в том, чтобы предусмотреть два датчика,лишь один из которых подвергается воздействию аналита, а другой не подвергается воздействию аналита и служит в качестве источника опорного сигнала. Помимо того, что нужны два датчика, а следовательно, предполагаются двойные расходы,сложность этого подхода состоит в том, что датчики не могут находиться в идентичных условиях, а следовательно, точность опорного сигнала остается под вопросом. Сущность изобретения Согласно настоящему изобретению предлагается способ калибровки датчика, находящегося под землей, так чтобы соединение-медиатор и содержащий его датчик обладали полезным сроком службы, несмотря на то, что концентрация соединения-медиатора со временем постепенно уменьшается. Хотя эта проблема разлагающегося соединениямедиатора была выявлена в контексте определения сульфидных частиц, для которых это изобретение фактически обладает особенной применимостью,оно применимо и с другими аналитами. Это изобретение можно применять в тех случаях, когда электрохимический аналитический процесс предусматривает использование соединениямедиатора, концентрацию которого приходится определять. В одном своем аспекте данное изобретение предлагает способ анализа флюида на анализируемое вещество (аналит), включающий обеспечение наличия датчика, содержащего электроды и соединение-медиатор, способное претерпевать цикл окисления и восстановления в ответ на изменение потенциала, поданного на электроды, причем соединение-медиатор способно также претерпевать часть этого цикла путем реакции с аналитом контактирование датчика и флюида,достаточное для того, чтобы аналит реагировал с медиатором подачу потенциала на электроды и обнаружение протекающего тока в течение достаточного времени для реакции между соединением-медиатором и аналитом, чтобы тем самым сделать возможным обнаружение концентрации присутствующего анализируемого вещества отличающийся тем, что этот способ также включает калибровку датчика путем подачи на электроды быстро меняющегося потенциала и обнаружение протекающего тока, причем изменение этого потенциала и обнаружение тока производят достаточно быстро,чтобы наблюдать за электрохимическим окислением и восстановлением соединения-медиатора, происходящим независимо от концентрации аналита, и тем самым обнаружить концентрацию соединения-медиатора. Изменяющийся потенциал, требуемый для этой стадии калибровкипо изобретению, может быть варьирующимся непрерывно или меняющимся дискретно или импульсно. В изложенном выше способе стадияобладает эффектом выделения фоновых (базовых) условий, какие наблюдались бы в отсутствии аналита, из условий с присутствующим аналитом. Это позволяет проводить калибровку датчика путем обнаружения текущей концентрации соединениямедиатора, что позволяет находить концентрацию аналита по результатам обнаружений, проведенных на стадииэтого способа. Это изобретение не ограничивается ни конкретным химическим соединением- медиатором,ни конкретной электрохимической реакцией медиатора. Однако электрохимическое изменение может представлять собой окисление и/или восстановление,и такой окислительновосстановительной реакцией может быть изменение степени окисления медиатора, вызванное переносом электронов. Предлагаемый по изобретению способ может быть осуществленпод землей, особенно в забое скважины. Флюидами, которые можно подвергать анализу, являются, например, грунтовая вода или рассол, а также ископаемые углеводороды, такие как природный газ или сырая нефть. Однако этот способ можно было бы осуществлять и на поверхности, возможно, для анализа добытых углеводородов или для анализа выходящего наружу потока. Датчик, используемый в предлагаемом по изобретению способе, может представлять собой датчик уже известного типа. Он может являться электрохимической ячейкой Кларка, в которой электроды контактируют с жидким электролитом, а соединение-медиатор растворено в электролите. В подобном устройстве электролит может быть отделен от другой текучей среды мембраной,проницаемой для аналита, чтобы аналит мог проникать из подземного флюида в электролит. Датчик подобного рода, предназначенный для анализа на сульфид в скважине, описан в заявке 2004/063743. Ячейка этого типа, в которой микроэлектроды с тонким слоем электролита отделены мембраной из политетрафторэтилена(ПТФЭ) от подвергаемого анализу флюида, была описана в . ., 2003, . 75, . 2499-2503. Еще в одной возможной конструкции датчика соединение-медиатор и электролит могут содержаться внутри пористого электрода, как описано в заявке 2004/011929, причем этот пористый электрод может быть отделен от подземного флюида мембраной, проницаемой для аналита. Также электроды могут быть нанесены методом трафаретной печати на изолирующую подложку, как было описано в заявке 2004/011929. Подобное устройство было описано также в . ., 2003,. 75, . 2054-2059, где предлагается, что соединение-медиатор должно быть нерастворимым соединением, смешанным с электродом на углеродной основе. И тогда электролит может обеспечиваться компонентами, присутствующими в предназначенном для анализа флюиде. Подача потенциала на стадииизложенного выше способа может представлять собой подачу постоянного потенциала, например, потенциала, при котором протекающий ток, связанный с окислением,принимает максимальное значение. Или же можно подавать переменный потенциал и наблюдать за током при изменении потенциала. Однако эти изменение и наблюдение за током должны 3 предоставлять время для реакции медиатора с аналитом, тогда как изменение потенциала на стадии калибровкиэтого способа должно быть значительно быстрее, чем изменение потенциала на стадии , чтобы электрохимическое окисление и восстановление соединения-медиатора происходило независимо от концентрации аналита. Конкретнее, подачу потенциала на стадииэтого способа можно проводить в виде циклической вольтамперометрии, при которой подаваемый на рабочий электрод потенциал циклически меняется в достаточном диапазоне, чтобы вызвать реакции окисления и восстановления, с регистрацией протекающего тока по мере изменения потенциала. Такая циклическая вольтамперометрия была описана и проиллюстрирована в ,2000, . 12, . 1453 и в более поздних документах,в том числе 2004/063743. Зарегистрированный ток демонстрирует пики при потенциалах,связанных с реакциями восстановления и окисления. Циклическую вольтамперометрию обычно осуществляют с непрерывно изменяющимся потенциалом, меняющийся достаточно медленно,чтобы электрохимически окисленное соединениемедиатор могло прийти в контакт с аналитом в электролите. Альтернативно, можно подавать потенциал, который меняется ступенчато, а не непрерывно, при условии, что ступеньки будут достаточно длинными, чтобы успевало установиться равновесие перед следующей ступенькой потенциала. Можно также проводить это изменение потенциала с регистрацией протекающего тока только на части цикла окисления и восстановления. Такой способ обычно относят к вольтамперометрии с линейной разврткой потенциала. Отличительный признак, которым является калибровка,проводимая на стадии предлагаемого по изобретению способа, как изложено выше, можно реализовать в виде одного из различных вариантов импульсной вольтамперометрии, предпочтительно в виде квадратно-волновой вольтамперометрии. Теперь будут даны более подробные объяснения и будут приведены примеры осуществления этого изобретения со ссылкой на следующие фигуры. Краткое описание фигур На фиг.1 показана форма волнового сигнала,используемого в циклической вольтамперометрии. На фиг.2 показаны результаты, полученные при использовании циклической вольтамперометрии для растворов с разными концентрациями сульфида, а также показан график зависимости пикового тока от концентрации сульфида. На фиг.3 показаны последовательности вольтамперограмм, снятых с интервалами при двух разных температурах. На фиг.4 приведен график изменения протекающего тока со временем при разных температурах. На фиг.5, 6 и 7 приведены схематические изображения форма волновых сигналов, 4 используемых в импульсной вольтамперометрии,вместе с типичными результатами наблюдений. На фиг.8 приведены результаты, полученные при использовании квадратноволновой вольтамперометрии для растворов с разными концентрациями сульфида. На фиг.9 приведены результаты, полученные при использовании квадратноволновой вольтамперометрии для растворов с разными концентрациями 3 и разными концентрациями сульфида. На фиг.10 приведено схематическое изображение скважинного инструмента,находящегося в скважине. На фиг.11 приведено схематическое изображение в сечении электрохимического датчика внутри инструмента, показанного на фиг. 10. На фиг.12 показаны электроды с одной лицевой стороны электродного блока в датчике, показанном на фиг.11. Подробное описание изобретения Циклическую вольтамперометрию обычно проводят, используя электрохимическую ячейку с тремя электродами рабочим электродом,противоэлектродом и электродом сравнения. На рабочий электрод подают потенциал, меняющийся относительно электрода сравнения. Этот потенциал изменяют, обычно линейно, за некоторый период времени в цикле от нижнего предельного значения до верхнего предельного значения, а затем обратно,после чего этот цикл может повторяться. Этот линейно изменяющийся волновой сигнал с повторением цикла имеет форму, схематически показанную на фиг.1. При этой процедуре прямому измерению подвергается ток, протекающий после подачи потенциала. Особый интерес представляют пиковые значения протекающего тока вместе с приложенными потенциалами,при которых наблюдаются эти пиковые значения тока. Однако данные, полученные при проведении эксперимента циклической вольтамперометрии, можно также использовать в качестве входных данных для компьютерной программы, предназначенной для моделирования происходящих химических процессов. На фиг.2 приведены результаты лабораторного эксперимента,в котором циклическую вольтамперометрию проводили при комнатной температуре на водных растворах с 6,5,содержащих 0,5 мМ сульфоната третбутилферроцена(3) и имеющих возрастающие концентрации сульфида. Для этого лабораторного эксперимента в качестве рабочего электрода можно использовать стеклоуглеродный электрод, а в качестве электрода сравнения нормальный каломельный электрод. Слева на фиг.2 приведены вольтамперометрические отклики (называемые иногда вольтамперограммами), полученные при линейном сканировании(т.е. изменении) подаваемого на рабочий электрод потенциала относительно электрода сравнения в диапазоне(нижняя кривая) выявил окислительную волну при 0,4 В и соответствующую восстановительную волну при 0,3 В. Это согласуется с окислением и восстановлением окислительно-восстановительной пары ферроцен/феррициний. В присутствии сульфида слева на вольтамперограммах наблюдается увеличение окислительного пикового тока наряду с сопутствующим уменьшением восстановительной волны. Справа приведен график зависимости окислительного пикового тока от концентрации сульфида,связанный соединительными линиями с соответствующими вольтамперограммами. Эти изменения в присутствии сульфида обусловлены тем, что по меньшей мере некоторые из окисленных частиц феррициния претерпевают восстановление в результате гомогенной химической реакции с сульфидом в растворе, а не электрохимического восстановления. Из-за доступности этого альтернативного пути восстановления окислительный ток увеличивается, а восстановительный ток уменьшается. Гомогенное химическое восстановление требует взаимодействия между молекулами окисленного медиатора (т.е. соединения ферроциния) и молекулами аналита. Следовательно, скорость этого восстановления будет зависеть и от концентрации соединения-медиатора,и от концентрации сульфида, являющегося аналитом. Скорость сканирования, т.е. ту скорость, с которой меняется поданный электрический потенциал, выбирают достаточно низкой, чтобы соединение-медиатор,подвергшееся электрохимическому окислению,имело время продиффундировать и столкнуться с аналитом, чтобы оно подверглось восстановлению в результате реакции в растворе. Как упоминалось выше, такую циклическую вольтамперометрию в присутствии медиатора можно использовать для обнаружения концентрации аналита - сульфида, реализуя стадиюизложенного выше способа. Однако для получения значимых результатов при проведении вольтамперометрического эксперимента нужно знать концентрацию присутствующего соединениямедиатора. Автор данного изобретения обнаружил,что при повышенных температурах это становится проблематичным. На фиг.3 приведены вольтамперометрические отклики 0,5 мМ-ных растворов - -3 ( 7),полученные в отсутствии сульфида за промежуток в 24 часа при 87 С и 133 С соответственно. В каждом случае приведенные вольтамперограммы снимали с часовыми интервалами. Хотя при 87 С и отмечалось некоторое смещение пикового потенциала, за 24 часовой промежуток наблюдалось лишь небольшое падение (примерно 15) окислительного пикового тока. Это может быть обусловлено термическим разложением соединения-медиатора. Когда температуру подняли до 133 С, наблюдалось гораздо большее уменьшение (примерно 87) окислительного пикового тока. Это свидетельствует о том, что соединение-медиатор 3 разлагается при таких температурах, подтверждая гипотезу о том, что процесс разложения является термически активируемым. Таким образом,концентрация соединения-медиатора 3 перестает быть известной величиной. Разложение соединения-медиатора при разных температурах показано также на фиг.4. На нем приведены графики изменения окислительного пикового тока во времени для каждой из пяти температур. Все приведенные значения представляют собой остаточный процент от исходного количества при соответствующей температуре. Четко видно, что при повышении температуры от 87 до 133 С потеря соединениямедиатора, ведущая к потере аналитического сигнала, происходит все быстрее. Для устранения этой проблемы согласно этому изобретению обнаруживают концентрацию медиатора при быстром изменении приложенного потенциала. В обычной циклической вольтамперометрии изменение электрического потенциала происходит достаточно медленно,чтобы соединение-медиатор,подвергшееся электрохимическому окислению, имело время продиффундировать и столкнуться с аналитом для того, чтобы восстановиться за счет химической реакции с аналитом. В противоположность этой практике проведения циклической вольтамперометрии с медленным изменением электрического потенциала, когда подают быстро изменяющийся потенциал, как требуется на стадии предлагаемого по изобретению способа,времени на диффузию соединения-медиатора недостаточно, так что химическое восстановление аналитом-сульфидом не происходит или почти не происходит. Эта химическая реакция не может теперь успешно конкурировать с электрохимическим восстановлением или, говоря другими словами,электрохимическое восстановление превалирует над химической реакцией. Как будет теперь показано, следствием этого является то, что электрохимический процесс становится независящим от присутствия аналита. Имеется несколько возможностей для обеспечения быстрого изменения потенциала,требующегося на стадии калибровки предлагаемого по изобретению способа. Одна возможность состоит в том, чтобы использовать циклическую вольтамперометрию с настолько большой скоростью сканирования, чтобы изменение приложенного потенциала стало быстрым. Расчеты,проведенные с использованием моделирующей программы, показали, что подходящей была бы скорость сканирования в 15 В/с. Другие возможности состоят в том, чтобы применить одну из различных форм импульсной вольтамперометрии. Существует три основных импульсных метода, а именно, нормальная импульсная вольтамперометрия(КВВ). Все три метода предусматривают 5 ступенчатое изменение приложенного потенциала и быстрое измерение протекающего тока в промежутках между изменениями. Следующее описание этих методов демонстрирует в иллюстративных целях,что приложенный потенциал является положительным и вызывает электрохимическое окисление. Однако следует признать, что эти методы можно осуществлять и при подаче отрицательного потенциала,вызывающего электрохимическое восстановление. На фиг.5 А показан волновой сигнал,используемый при нормальной импульсной вольтамперометрии. Существует опорный потенциал, подаваемый на электрод сравнения, и через некоторые интервалы этот потенциал ступенчато повышается до более высокого значения, удерживается при этом значении в течение короткой длительности,а затем возвращается к опорному значению. Эти ступеньки потенциала постепенно увеличиваются. Импульсы, т.е. ступенчатые приросты до более высокого потенциала, имеют небольшую длительность и разделены интервалами гораздо большей длительности с опорным потенциалом. Измерения протекающего тока производят вблизи от конца импульса, как показано точкамина фиг. 5 А. Полученные данные состоят из последовательности значений приложенного потенциала вместе со значениями тока, измеренного при этих потенциалах. Эти данные можно представить в виде графика подобно окислительной части вольтамперограммы,полученной в циклической вольтамперометрии с непрерывно меняющимся потенциалом. Но поскольку импульсы коротки, каждое измерение тока производится прежде,чем электрохимический процесс подвергнется влиянию гомогенного химического восстановления. Как показано схематически на фиг.5 В, на графике наблюдается рост тока по мере того, как импульсы достигают потенциала,необходимого для осуществления окисления. На фиг.6 А показан волновой сигнал,используемый при дифференциальной импульсной вольтамперометрии. И снова приложенный потенциал ступенчато повышается короткими импульсами, разделенными интервалами гораздо большей длительности, но он наложен на опорный сигнал ступенчатой формы, так что опорный потенциал нарастает после каждого импульса. Протекающий ток измеряют непосредственно перед тем, как начинается каждый импульс, как показано точками а на фиг. 6 А, а также измеряют непосредственно перед тем, как заканчивается каждый импульс, как показано точкамина фиг.6 А. Определяют разницу между значением тока,измеренным в каждой точке , и между значением тока, измеренным в соседней точке а, и эту разность между двумя измеренными значениями регистрируют в качестве выходного сигнала этого метода. На фиг. 6 В эта разница схематически показана на графике зависимости тока от приложенного потенциала. Когда опорный потенциал гораздо ниже 6 требуемого для окисления, скачок потенциала оказывает небольшое влияние на протекающий ток,и разница в токе до и во время импульса возросшего потенциала незначительна, как показано слева на фиг. 6 В. Когда опорный потенциал гораздо больше значения,требуемого для окисления,электрохимический процесс протекает со скоростью, ограниченной диффузией, и нарастание потенциала во время импульса не слишком сильно увеличивает скорость реакции, так что разность тока во время импульса более высокого потенциала довольно мала, как показано справа на фиг. 6 В. Однако в промежутке между этими предельными значениями нарастание потенциала во время импульса приводит к значительному увеличению тока, и на графике изменения разности токов наблюдается пик при потенциале, связанном с электрохимическим окислением, как показано на фиг. 6 В. На фиг.7 А показан волновой сигнал,используемый в квадратно-волновой вольтамперометрии,которая является предпочтительным методом для отличительной стадиипредлагаемого по изобретению способа. Прямоугольная волна сочетается со ступенчатым опорным сигналом, так что потенциалы, подаваемые на пиках и впадинах прямоугольной волны,постепенно возрастают. Протекающий ток измеряют ближе к концу каждого пика и впадины прямоугольной волны, как показано точкамиина фиг. 7 А. Амплитуду прямоугольной волны выбирают достаточно большой, чтобы на по меньшей мере части развертки потенциал на пике прямоугольной волны вызывал окисление и измеряемый ток был прямым током, в то время как потенциал на впадине прямоугольной волны обращал окисление и измеряемый ток был обратным током. Как пики, так и впадины прямоугольной волны являются импульсами малой длительности (обычно впадины и пики имеют одинаковуюдлительность), так что каждое измерение тока производится прежде, чем на электрохимический процесс окажет влияние какоелибо гомогенное химическое восстановление, как и при других видах импульсной вольтамперометрии. В результате эксперимента квадратно-волновой вольтамперометрии можно получать три выходных сигнала. Один из них представляет собой приложенные потенциалы и соответствующий им ток в точках , т.е. на пиках прямоугольной волны,представленный в виде кривойна фиг.7 В. Другой представляет собой приложенные потенциалы и соответствующий им ток в точках г,т.е. на впадинах прямоугольной волны,представленный в виде кривой . Третий представляет собой приложенные потенциалы и соответствующую им разность токов. Он представлен в виде кривойна фиг.7 В, и в случае дифференциальной импульсной вольтамперометрии он нарастает до пикового значения при потенциале,связанном с электрохимическим окислением. Одним преимуществом квадратно-волновой вольтамперометрии является то, что пик на кривой больше пиков на графиках прямого и обратного токаи , так что этот метод обладает хорошей чувствительностью. Другим преимуществом является то, что этот метод можно осуществлять при более высокой скорости сканирования, чем при других видах импульсной вольтамперометрии, так что измерения можно производить быстро. На фиг. 8 приведены кривые разности токов (т.е.), полученные методом квадратно-волновой вольтамперометрии для растворов с 7 и 0,5 мМ -3 и увеличивающимися концентрациями сульфида при комнатной температуре. Концентрации сульфида ступенчато варьировались в диапазоне от 0 до 1 мМ шагами по 0,2 мМ. Как можно видеть,эти кривые фактически накладываются друг на друга, свидетельствуя о том,что с помощью этой квадратно-волновой вольтамперометрии электрохимическое окисление и восстановление 3 было успешно отделено от его восстановления сульфидом. Это было подтверждено еще и данными,приведенными на фиг. 9. Квадратно-волновую вольтамперометрию использовали при комнатной температуре для растворов с 7, содержащих разные концентрации 3 и разные концентрации сульфида. На фиг.9 А приведен график окислительного пикового тока (т.е. максимума на кривой ( как функции концентрации сульфида для разных концентраций -3, и можно видеть, что зарегистрированные значения фактически не зависят от концентрации сульфида. На фиг.9 В те же самые данные представлены в виде графика зависимости окислительного пикового тока от концентрации -3. Точки ложатся на прямую линию,показывая, что измеренные значения пикового тока были пропорциональны концентрации соединениямедиатора 3. На фиг.10-12 показано оборудование,используемое для осуществления предлагаемого по изобретению способа под землей в скважине. Инструмент 10 содержит продолговатый,практически цилиндрический корпус, подвешенный на канате 14 в скважине 16, смежно с той формацией 18, которую считают содержащей извлекаемые углеводороды. Инструмент снабжен отходящим в радиальном направлении пробоотборником 20. Пробоотборник 20 приведен в тесный контакт с формацией 18 под действием снабженных гидроприводом толкателей 22,выступающих в радиальном направлении из инструмента с противоположной от пробоотборника 20 стороны, и подсоединен внутри инструмента к трубе 26. Внутри инструмента 10 можно использовать насос 28, чтобы отбирать пробу углеводородов в трубу 26. Насосом 28 управляют с поверхности земли над скважиной по канату 14 с помощью схемы управления (не показана) внутри инструмента. Труба 26 проходит через электрохимический датчик 30, расположенный возле пробоотборника 20. Датчик 30 изображен довольно схематически в разрезе на фиг.11. Он может быть сконструирован так, как более подробно описано в заявках 2004/063743 и/или 2005/066618. Датчик 30 имеет в целом цилиндрическую форму. Проток, по которому поступает флюид, содержание сульфида в котором следует определить, проходит через датчик 30 и образует часть трубы 26. Газонепроницаемая мембрана 36 отделяет этот проток от просверленного в датчике осевого отверстия, внутри которого расположен электродный блок 38. Этот блок 38 содержит изолирующий корпус, имеющий на своей лицевой поверхности 40 три электрода, а именно, рабочий электрод 42 из легированного бором алмаза, электрод 44 сравнения в виде серебряной точки, покрытой хлоридом серебра или иодидом серебра,и противоэлектрод 46,содержащий печатную платиновую дорожку. Электроды 42, 44, 46 соединены соответствующими электрическими проводниками, запрессованными в корпус электродного блока 38 и проходящими в осевом направлении сквозь корпус электродного блока 38, с соответствующими электрическими проводами 48, которые соединяют датчик 30 со схемой 32 управления внутри инструмента. Пространство 50 между лицевой стороной 40 электродного блока и мембраной 36 заполнено полярным электролитом,который может представлять собой водный раствор, в котором растворено соединение- медиатор 3. Как только инструмент окажется на месте,флюид откачивается насосом 28 по трубе 26. Имеющийся во флюиде сероводород может проникать сквозь мембрану 36 в электролит в пространстве 50. После некоторого времени для установления равновесия схема 32 управления(возможно, по команде, поступающей по канату 14) подает переменный потенциал на электроды и измеряет протекающий ток. Это проделывают в виде циклической вольтамперометрии при скорости сканирования, которая достаточно низка, чтобы предоставить время для реакции между соединением-медиатором и сульфидом,поступившим в электролит. Протекающий ток и поданный потенциал могут быть переданы на поверхность в реальном масштабе времени по канату 14 или могут регистрироваться до тех пор,пока инструмент не будет поднят на поверхность. Отдельно,либо до,либо после этого вольтамперного измерения, блок 32 управления подает прямоугольный волновой сигнал на электроды, чтобы откалибровать датчик 30 методом квадратно-волновой вольтамперометрии. Протекающий ток регистрируется во время пиков и впадин прямоугольной волны, как описано выше со ссылкой на фиг.7. Зарегистрированный ток и/или значения разности токов вместе с соответствующими значениями приложенного потенциала можно передавать на поверхность по канату 14 или заносить в память, пока инструмент не будет поднят на поверхность. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ анализа флюида на содержание анализируемого соединения, включающий создание датчика, содержащего электроды и медиаторное соединение, способное подвергаться циклу окисления и восстановления в ответ на изменение потенциала, поданного на электроды,причем это соединение способно также осуществлять часть цикла путем взаимодействия с анализируемым соединением контактирование датчика и флюида,достаточно длительное, чтобы анализируемое соединение могло прореагировать с медиатором подачу потенциала на электроды и измерение тока, достаточно длительное, чтобы анализируемое соединение могло прореагировать с медиатором и чтобы можно было измерять концентрацию анализируемого соединения и калибровку датчика путем подачи быстро меняющегося потенциала на электроды и измерения тока, причем изменение потенциала и измерение тока производится достаточно быстро, чтобы обеспечить и наблюдать электрохимическое окисление и восстановление медиатора,происходящее независимо от концентрации анализируемого соединения, и тем самым определять концентрацию медиаторного соединения. 2. Способ по п.1, отличающийся тем, что медиаторное соединение растворяют в проводящем электролите, отделенном от флюида мембраной,проницаемой для анализируемого соединения. 3. Способ по п.1, отличающийся тем, что подачу потенциала на электроды (на стадии ) для измерения концентрации анализируемого соединения проводят путем подачи переменного потенциала. 4. Способ по п.1, отличающийся тем, что подачу потенциала на электроды (на стадии ) для измерения концентрации анализируемого соединения проводят в виде циклической вольтамперометрии. 5. Способ по п.1, отличающийся тем, что калибровку датчика (на стадии ) проводят в виде циклической вольтамперометрии с достаточно большой скоростью сканирования, чтобы окисление и восстановление медиатора происходило независимо от концентрации анализируемого соединения. 6. Способ по п.1, отличающийся тем, что калибровку датчика (на стадии ) проводят в виде импульсной вольтамперометрии. 7. Способ по п.6, отличающийся тем, что стадию калибровки датчика (на стадии ) проводят в виде квадратно-волновой вольтамперометрии. 8. Способ по п.1, отличающийся тем, что анализируемое соединение восстанавливает медиаторное соединение. 9. Способ по п.1, отличающийся тем, что анализируемое соединение представляет собой сероводород и/или сульфид-анион. 10. Способ по п.1, отличающийся тем, что анализируемое соединение окисляет медиаторное соединение. 11. Способ по п.1, проводимый под землей,чтобы определять содержание анализируемого соединения в подземном флюиде. 12. Способ по п.11, отличающийся тем, что датчик представляет собой часть инструмента,спускаемого в скважину. 13. Способ по п.11, отличающийся тем, что подземный флюид представляет собой ископаемый углеводород. 14. Способ по п.11, отличающийся тем, что подземный флюид представляет собой подземную воду или рассол.
МПК / Метки
МПК: E21B 47/00, G01V 3/18, G01N 33/18, G01N 27/26
Метки: калибровка, электрохимического, датчика
Код ссылки
<a href="https://kz.patents.su/12-27673-kalibrovka-elektrohimicheskogo-datchika.html" rel="bookmark" title="База патентов Казахстана">Калибровка электрохимического датчика</a>
Предыдущий патент: Гидродинамический кавитатор
Следующий патент: Устройство для измерения физических параметров ядерных материалов и способ использования такого устройства
Случайный патент: Способ непрерывной двухстадийной очистки цинковых растворов от примесей